[실험 목적]
반응용액의 흡광도를 측정하여 반응물과 생성물의 평형농도, 평형상수를 결정한다. 또한 이 반응에서 Le Chatelier 원리를 확인한다.
[실험 이론]
다음 실험 이론을 조사하시오.
1. 화학 평형과 평형상수의 개념에 대해 설명하시오.
1-1. 화학평형
평형은 균형 상태를 말한다. 같은 힘으로 줄의 두 끝을 당겼을 때 줄이 움직이지 않는 줄다리기는 정적(static) 평형의 한 예이다. 또한 평형은 전체적으로는 변화가 없지만, 정반응 과정과 역반응 과정이 같은 속도로 일어나는 것과 같이 동적(dynamic)일 수도 있다.
앞의 몇 장에서 증기압, 포화용액형성 및 Henry법칙을 포함하여 물질의 물리적 변화와 관련된 동적 평형의 여러 사례를 이미 만나 보았다. 한 예로 증기압을 생각해 보자. 밀폐된 용기에서 액체 위의 증기압은, 분자가 액체에서 기체상으로 빠져나가는 속도와 기체상의 분자가 액체에 의해 포획되어 액체가 되는 속도가 같을 때 변화를 멈춘다. 증발과 응축. 또는 용해와 결정화와 같이. 화학 반응은 정방향과 역방향으로 진행될 수 있다. 역반응이 충분히 느리면, 그동안 우리가 접했던 반응들에서 해왔던 것처럼 역반응을 무시할 수 있다. 그러나 정반응과 역반응의 속도를 함께 고려해야만 하는 중요한 예가 많이 있다.
화학 평형(chemical equilibrium)은 정반응과 역반응이 같은 속도로 진행될 때 발생한다.
반응이 평형상태에 있을 때, 반응물로부터 생성물이 형성되는 속도는 생성물로부터 반응물이 형성되는 속도와 동일하다. 그 결과. 농도는 변하지않고 반응은 완료되기 전에 멈춘 것처럼 보인다.
평형상태(equilibrium state)에 어떻게 도달하는지 이해하기 위해 반응물과 생성물의 농도가 시간에 따라 더 이상 변하지 않는 간단한 화학 반응을 예로 들어 보자. 무색의 N2O4 가 갈색의 NO2 로 분해되는 과정을 생각해 보자. 그림 15.1은밀봉된 튜브속에 얼어있는 N2O4고체 시료를 보여준다. 고체의 N2O4는 끓는 점(21.2C)이상의 온도로 가열되면 무색의 N2O4기체에서 갈색의 NO2 기체로 분해되어 점차적으로 짙어진다. 최종적으로, 관 안에 N2O4기체가 남아 있더라도, 평형에도달하였기 때문에 튜브 내부의 색은 일정색상이상으로 짙어지지 않는다. 즉시간이 지나도 기체의 농도가 변하지않는 N2O4 와 NO2 의 평형 혼합물(equilibrium mixture)을 얻게 된다. 반응이 닫힌계에서 일어났기 때문에 기체는 빠져나갈 수 없고, 평형 혼합물은 유지된다. 평형 혼합물은 반응이 가 역적(reversible)이기 때문에 생기는 결과이다. N2O4가 NO2 를 생성할 뿐만 아니라, NO2 가 N2O4 를 생성할 수 있다. 동적 평형은 반대방향을 가리키는 두개의 반쪽 화살표로 반응식을 써서 표현한다.
N2O4(g) 무색 <--> 2NO2(g) 갈색
반응속도론적 지식을 이용하여 이러한 평형을 분석할 수 있다. N2O의 분해를 정반응이라고 하고, N2O4의 생성을 역반응이라고 하자. 이 경우, 정반응과 역반응은 모두 단일단계 반응(elementary reaction)이다. 14.6절에서 배운 것과 같이, 화학식에서 단일단계 반응의 속도 법칙은 다음과 같이 쓸 수 있다.
정반응 : N2O4(g) - >2NO(g) 속도f = kf(N2O4] [15.2]
역반응: 2NO2(8)-N2O4(g) 속도r =kr[NO2]2 [15.3]
평형에서는 정반응에서의 NO2 생성속도와 역반응에서의 N2O4 생성속도가 동일하다.
kf[N2O4] = Kf[NO2]2
정반응역반응이식을 다시 정리하면 다음의식을 얻는다.
[NO2]^2 / [N2O4] = kf / kr = 상수
두개의 속도 상수로 계산된 값이 또다른 상수라는 것을 식 15.5로부터 알 수 있으며, 우리가 배울이 또 하나의 상수를 평형상수라고 한다. 또한, 평형상태에서 농도 항의 비율이 상수와 같음을 알 수 있다. 평형상수는 N2O4 로 시작하든지, NO2 로 시작하든지, 또는이 둘의 혼합물로 시작하든지 간에 아무런 차이가 없다. 주어진 온도에서의 평형에서는 그 비가 특정한 값이 된다. 따라서 평형에서 N2O4 와 NO2 의 비에는 중요한 제한 요건이 있게 된다.

그림 15. 2(a)에서와 같이, 일단 평형에 도달되면 N2O4, 와 NO2 의 농도는 더 이상변하지 않는다. 그러나 평형 혼합물의 조성이 시간에 따라 변하지않는다는 것이 N2O4, 와 NO2, 의 반응이 멈춘다는 것을 의미하지는 않는다. 오히려 평형은 동적(dynamic)이어서 약간의 N2O4, 는 NO2, 로 변환되고, 약간의 NO2, 는 N2O4, 로 변환된다. 그러나 평형에서는 그림 15. 2(b)에 나타낸 것과 같이. 두 과정이 같은 속도로 일어난다. 이 예로부터 평형에 관한 몇가지 중요한 사항을 알게 된다.
평형에서는 반응물과 생성물의 농도 변화가 더이상 없다.
평형이 일어나기 위해서는 반응물이나 생성물이 반응계로부터 빠져나가면 안된다.
평형에서 농도 항간의 특정비율은 상수이다.
1-2. 평형상수 K
같은 용기내에서 반응물이 생성물로 변하고, 생성물이 반응물로 변하는 반응은, 그 반응이 얼마나 복잡한지에 관계없이 그리고 정반응과 역반응의 반응속도론적 과정에 관계없이 자연스럽게 평형에도달하게 된다. 질소와 수소로부터 암모니아를 합성하는 다음 반응을 생각해 보자.
N2(g)+3H(g) -> 2NH3(g) [15.6]
이 반응은 Haber공정(Haberprtoces)의 기초가 되며 비료 생산에 필수적이다. 따라서 세계식량 공급에 중요하다. Haber공정에서는 N2와 H2를 고온,고압에서 촉매 존재하에 반응시켜 암모니아를 합성한다. 그러나 닫힌계에서 이 반응은 N와 H를 완전히 소모하지 못한다. 오히려 세성분모두 혼합물에 동시에 존재하면서, 어느 시점에 반응이 멈춘 것처럼 보인다.
그림 15. 3은 시간에 따라 H2, N2. NH3, 의 농도가 변하는 것을 나타낸 것이다. N와 H. 로부터 시작하든지, NH, 만으로 시작하든지에 관계없이, 하나의 평형 혼합물이 얻어짐에 유의 하라. 평형조건은 양쪽 어느 방향으로부터도 도달할 수 있다.
식 15. 5와 비슷한 식이 평형에서의 N2 , H2, NH3, 의 농도를 결정한다. 처음 혼합물에서의 세가지 기체의 상대적 양을 체계적으로 변화시키고 각 평형 혼합물을 분석하면 평형 농도 사이의 관계를 결정할 수 있다. 화학자들은 Haber의 연구이전의 19세기에 다른 화학적 체계에서 이러한 종류의 연구를 수행하였다. 1864년에 Cato Maximilian Guldberg(1836~1902)와 Peter Wage(1833~1900)는 어떠한 반응에서든 평형에서 반응물과 생성물 농도 사이의 상관관계를 표시하는 질량 작용법칙(law of mass action)을 가정하였다. 일반적인 평형 반응식을 가정해 보자.
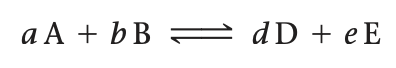
aA + bB <==> cC + dD
여기서 A, B, C, D는 반응에 관여하는 화학종이고, a, b, c, d는 균형을 맞춘화학 반응식의 계수이다. 질량 작용법칙에 따르면, 평형조건은 다음식으로 표시된다.
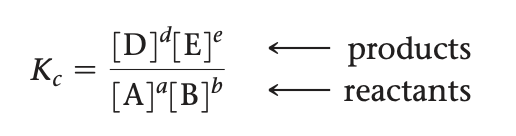
Kc = [D]^d [C]^c / [A]^a[B]^b
이 관계식을 반응의 평형상수식(equilibrium-constantexpresion)또는 평형식(equilbriumexpression)이라고 한다. 평형상수(equilibriumconstant, K)는 실제 평형 농도를 평형상수식에 대입하여 얻은 값이다. 아래 첨자 c는 상수값을 얻기 위해 사용한 몰농도 이다.
평형상수식의 분자는 평형 반응식의 생성물쪽에 있는 모든 물질의 농도 곱이고, 각 농도는 균형화학 반응식의 계수만큼 거듭제곱해서 대입한다. 분모는 평형 반응식의 반응물 쪽물질로부터 비슷하게 대입한다. 따라서 Haber공정. N2(g)+3H2(g) -> 2NH3(g)의 평형상수식은 다음과 같다.
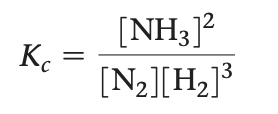
Kc = [NH3]2/ [N2][H2]^3 [15.9]
평형에 도달한 어떤 반응의 균형맞춘화학 반응식을 알면, 반응 메커니즘을 모르더라도 평형상수식을 쓸 수 있다.
평형상수식은 반응의 화학량론에만의 존하고 반응 메커니즘과는 무관하다.
따라서 평형상수식은 속도 법칙과 다르다. 일정한 온도에서 평형상수값은 반응물과 생성물의 초기 농도에 의존하지 않는다. 또한 반응물이나 생성물과 반응하지 않는 한. 다른 물질이 있더라도 관계없다. K값은 특정반응과 온도에만 의존한다.
출처: 브라운 일반화학 15판 p700 ~ 702 (15.1절 평형의 개념, 15.2절 평형상수)
2. 르 샤틀리에(Le Chatelier)의 원리에 대해 설명하시오.
르 샤틀리에(Le Chatelier)의 원리
프랑스의 공업화학자 Henri-Louis Le Chatelier(1850~1936)에 의해 처음으로 제안된다음과 같은 원리에 의하여 이해될 수 있다.
평형에 있는 어떤 계가 온도, 압력, 어느 성분의 농도 변화에 의해 교란을 받으면, 그 계는 그 교란 효과를 해소하는 방향으로 평형의 위치를 이동시킨다.
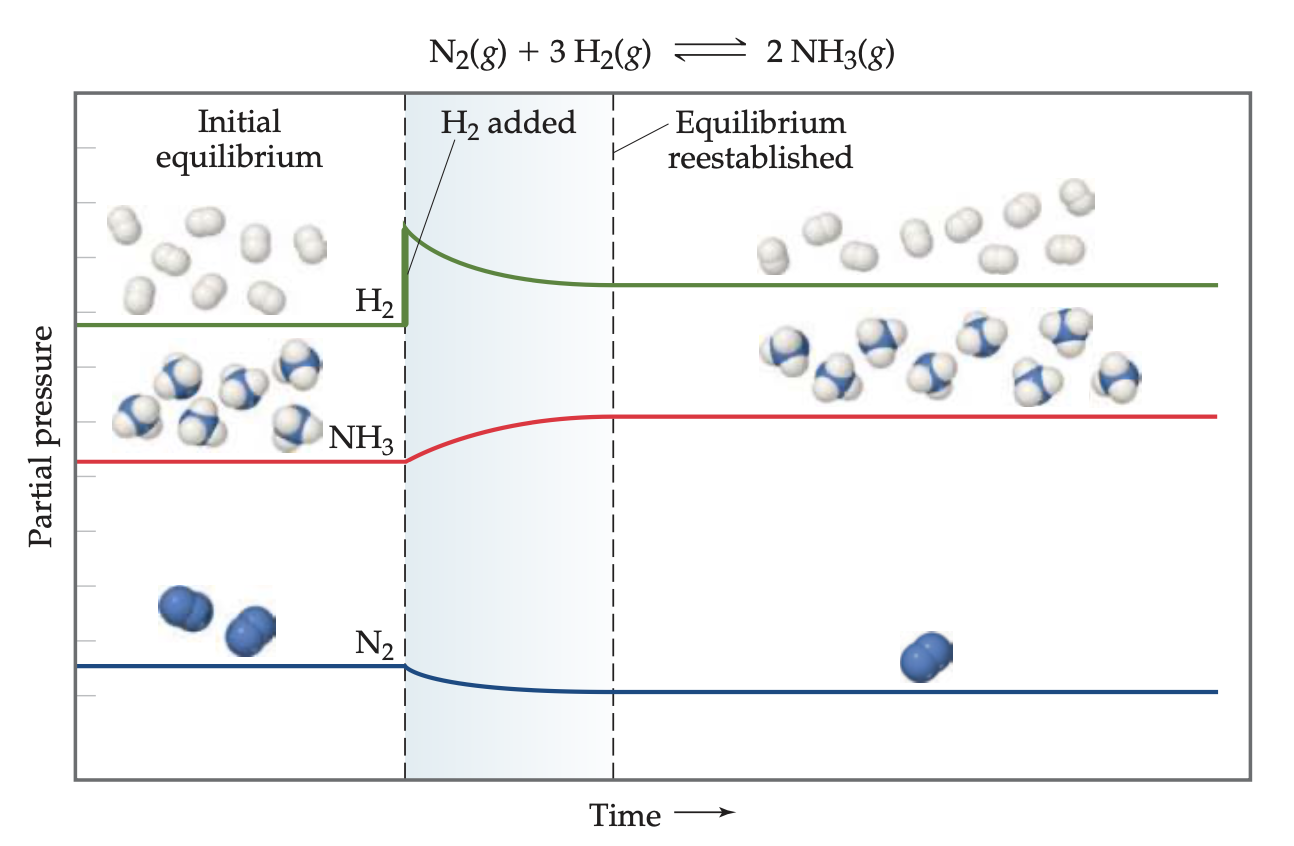
농도: 반응물 또는 생성물의 첨가 또는 제거 평형상태의 계에 어떠한 물질이 가해지면. 계는 그물질의 일부를 소모하도록 반응한다. 물질이 계에서 제거되면 계는 그물질을 더 많이 생성하도록 반응한다.
동적 평형에 있는 계는 균형상태에 있다. 반응에서 한 물질의 농도가 변화하면, 평형은 새로운 균형상태에 도달할 때까지 이동하게 된다. 이동(shiff)의 의미는 무엇인가? 이것은 새로운 상황에 맞도록 반응물과 생성물의 농도가 시간에 따라 변화하는 것을 의미한다. 이동이 평형상수자체의 변화를 의미하지 않는다. 즉 평형상수는 일정하게 유지된다. LeChitelier원리에 따르면, 평형의 이동은 변화의 효과를 최소화하거나 줄이는 방향으로 일어난다. 평형에 있는 계에서 어떤 물질(반응물이든 생성물이든)의 농도가 증가하면, 그 계는 그물질의 일부를 소모하도록 반응한다. 역으로 어느 물질의 농도가 감소하면, 계는 그물질을 더 많이 만들도록 반응한다.
부피및 압력:부피를 변화시켜 압력 변화시키기 일정온도에서 기체 상태의 평형 혼합물의 부피를 줄이면 계는 기체의 몰수를 감소시키는 방향으로 이동한다.
만일 한 개 이상의 기체를 포함한 어떤 계가 평형에 있고, 그 부피가 감소하여 전체 압력이 증가하면, LeChatelier원리에 따라 그 계는 압력을 감소시키려고 평형의 위치를 이동시킬 것이다. 계는 기체 분자의 전체 수를 감소시켜 압력을 줄일 수 있다(기체 분자수가 적을수록 압력은 더 낮게 나타난다). 따라서 일정한 온도에서 기체 평형 혼합물의 부피를 감소시키면, 계는 기체의 분자수를 감소시키는 방향으로 이동한다. 부피의 증가는 더 많은 기체 분자를 만드는 방향으로 이동시킨다
온도: 평형계의 온도를 높이면 계는 반응물을 흡열 반응에 가하거나 생성물을 발열 반응에 가한 것처럼 반응한다. 평형은 '과량의 시약' , 즉 열을 소모하는 방향으로 이동한다.
Le Chatelier원리로부터 K와 온도의 관계에 대한 규칙을 유도할 수 있다. 이를 위한 간단한 방법은 열을 화학시약처럼 취급하는 것이다. 흡열(endothermic, 열흡수)반응에서는 열을 반응물로, 발열(exothermic, 열방출)반응에서는 열을 생성물로 생각한다.
흡열 반응: 반응물 +열 <==>생성물
발열 반응: 반응물 <==>생성물 +열
평형에 있는 계의 온도를 증가시키면, 계는 흡열 반응에서 반응물을 더한 것 또는 발열 반응에서 생성물을 더한 것과 같이 반응한다. 평형은 과량의 반응물(또는 생성물), 즉 열을 소모하는 방향으로 이동한다.
흡열 반응에서는 반응물이 생성물로 변화함에 따라 열이 흡수된다. 따라서 온도를 높이면 생성물이 더 많이 생성되는 방향인 오른쪽으로 평형이 이동하고, K가 증가 한다. 발열 반응에서는 반대가 된다. 반응물이 생성물로 변할 때 열이 생성된다. 따라서 이 경우 온도를 높이면 더 많은 반응물이 생성되는 왼쪽으로 평형이 이동하며 K가 감소한다.
흡열 반응:온도를 높이면 K값이 증가 한다.
발열 반응:온도를 높이면 K값이 감소한다.
반응을 냉각하면 반대 효과를 나타낸다. 온도를 낮추면, 평형은 열을 생성하는 쪽으로 이동한다. 따라서 흡열 반응을 냉각하면 그림 15.13에서와 같이 평형은 왼쪽으로 이동하여 K가 감소하고, 발열 반응을 냉각하면 평형은 오른쪽으로 이동하여 K가 증가 한다.
출처 : 브라운 일반화학 15판 15.5 절 Le Chatelier의 원리 (p720 ~ 725)
3. Beer-Lambert의 법칙에 대해 설명하시오.
16.7절 정량적 계산
흡수분석물의 용액에 의하여 흡수되는 복사선의 분율은 물질의 농도와 정량적으로 관련지을 수 있다. 여기에서는 순수한 화합물과 혼합물 모두를 고려하고자 한다.
Beer법칙 -흡수된 복사선의 양과 농도 사이의 관계
어떤 시료에 의해 흡수된 단색파장의 복사선의 양은 보통 Beer법칙(Beer'slaw)이라 하는 Beer-Bouguer-Lambert법칙에 의하여 설명된다. 그림 16.9 와 같이 단색파장의 복사선의 흡수를 생각해 보자. 복사력이 P0 인 입사선이, 농도가 c이고 통로 길이가 6인 흡수종의 용액을 통해 지나면, 투과된 복사선은 P의 복사력을 갖는다. 이 복사력은 분광검출기에 의해 측정된 양이다. 1729년에 Bouguer와 1760년에 Lambert는 전자기에너지가 흡수될 때. 투과된 에너지의 힘이 기하학적으로(지수적으로)감소한다는 것을 알았다. 예를 들어, 그림 16. 9에서 복사에너지의 25%가 6의 통로 길이에서 흡수되었다고 가정하자. 남아있는 에너지의 25%(0. 75P의 25%)는 다음 통로 길이 b에서 흡수될 것이고, 56.25%는 투과된 복사선으로 남을 것이다. 이중 25%는 또다른 통로 길이 6에서 흡수될 것이고, 이와같이 결국에는 무한한 통로 길이가 모든 복사에너지를 흡수하기 위하여 필요하게 될 것이다. 투과된 복사에너지의 분율이 통로 길이에 따라서 지수적으로 감소하므로 다음과 같이 지수형태로 표시할 수 있다.
T = P / P0 = 10^-kb (16.4)
여기서 k는 상수이고, T는 투광도(transmittance)라고 하는 투과된 복사에너지의 분율이다. 이것을 로그 형으로 표시하면,
logT = logP/P0 = -kb (16.5)
돌이켜 생각해 보면, 무엇보다도 빛이 통과하는 통로의 길이가 빛의 감소를 지배하는 유일한 요소가 될 수없다는 것은 분명해 보인다. 빛의 흡수에 분자가 관여할 것이다. 단위 통로 길이 당빛을 흡수하는 분자들의 밀도(농도에 해당하는)가 반드시 역할을 해야 한다. 그러나 이러한 추가적인 중요한 관계가 탐구되기까지 거의 백년이 흘렀다. 1852년에 Beer와 1853년에 Bemard는 각 흡광도 1가 통로 길이와 같이 농도 C에 의존한다는 것을 발표하였다. 비록 그들은 이런 수식으로 발표하지는 않았지만, 수학적으로 식 16. 4와 비슷할 것이다.
T = P/P0 = 10^-k'c (16.6)
여기서 k'는 새로운 상수이고,
log T = log P/P0 = -k'c (16.7)
식 16.4와 16.6에 나타난 두 관계의 결합은 통로 길이와 농도에 대한 T의 의존성을 나타낸다.
T = P/P0 = 10^-abc
여기서 a 는 k 와 k'를 합한 상수이고,
log T = log P/P0 = -abc
식의 오른쪽에 있는 음의 표시를 없애고 새로운 개념인 흡광도(absorbance)를 정의하는 것이 더 편리하다.
A = -log T = log 1/T = log P0/P = abc (16.10)
여기서 A는 흡광도 이다. 식 16. 8에서부터 16. 10의 관계를 총괄하여 Beer법칙이라고 한다. 식 16. 10은 Beer법칙의 가장 일반적인 형태이다. 농도에 직접 비례하는 것이 흡광도라는 것을 주목하라.
퍼센트 투광도(percenttransmittance)는 다음과 같이 주어진다.
%T = P/P0 x 100 (16.11)
식 16.10은 다음과 같이 바꿀 수 있다. T= %T/100이므로,
A = log 100 / %T = log 100 - log % T
또는
A = 2.00 - log %T
%T = 10^(2.00-A)
그리고
T = 10^-A
다음의 흡광도와 투광도의 스프레드시트 계산과 도시는 투광도에서 직선적 변화의 함수로서의 흡광도의 지수함수적인 변화를 설명하고 있다.
식 16. 10에서 통로 길이 b는 cm로, 농도는 g/L로 표시되어 있다. 상수 a는 흡광계수(absorptivity)라고 하는데, 파장과 흡수하는 물질의 성질에 달려 있다. 흡수 스펙트럼에서 흡광도는 a에 비례하면서 파장에 따라 변한다(b와 c는 일정). 흡광계수와 흡수종의 분자량의 곱을 몰흡광계수(molarabsorptivity, e)라고 한다. 따라서 다음과 같이 쓸 수 있다.
A = ebc (16.13)
여기서 c는 리터당 몰수이다. 자외선과 가시 광선분광법에서 용기의 통로 길이는 흔히 1cm이고, e은 cm-1 x mol-1 L의 단위를 갖는 반면에, a는 cm-1 x g-1 L의 단위를 갖는다. 흡광계수가 파장에 따라 변하므로 엄밀히 말하면 Beer법칙은 단색파장의 복사선의 경우에만 성립된다.
출처: 분석화학 7판 16.7절 정량적 계산 (p 475 ~477)
4. 착이온 에 대해 설명하시오.
4-1. 착이온 (complex ion)
착물이 전하를 띠고 있을 때 착이온이라 한다. 착물이란 중심에 원자나 이온이 있고 그 주변에 여러 개의 다른 원자, 원자단, 이온, 분자 등이 입체적으로 배위하고 있어 하나의 원자집단이 된 물질을 의미한다. 착이온의 전하는 중심이온의 전하와 배위자의 전하를 합한 값이다. 예를 들어 [Co(NH3)6Cl2]+에서 중심이온인 코발트는 +3, 염화이온은 -1이다. 따라서 +3 + (-1) + (-1) = +1 이므로 전하는 +1이다.
출처: 사이언스 올 과학문화의 모든 것 검색어 '착이온'
4-2. 착이온이란?
착이온은 중심 금속 이온에 리간드가 결합하여 이루어진 이온을 말한다. 착이온에서 중심 금속 이온의 전하량은 착이온의 전하량에서 리간드의 총전하량을 뺀 값이다.
착이온은 중심 금속 이온에 리간드가 배위 결합하여 이루어진 복잡한 구조의 이온이다. 착이온은 배위수와 리간드의 종류에 따라 직선형, 정사면체형, 평면 사각형, 정팔면체 등의 기하학적 구조를 나타낸다.
착이온에서 중심 금속 이온의 전하량은 그 이온이 나타내는 전하량에서 리간드가 지니는 전하량을 모두 빼어 결정할 수 있다.
출처: 네이버 지식백과 검색어 '착이온 (complex ion)'
[화학및 실험1] 7주차 예비보고서, 미지시료에 포함된 양이온의 정성분석
에서도 조사한 내용이다 금속화학의 중요한내용중 하나다!
https://devlawyer.tistory.com/22
[화학및 실험1] 7주차 예비보고서, 미지시료에 포함된 양이온의 정성분석
[실험제목] 미지시료에 포함된 양이온(Ag+, Cd2+, Pb2+, Hg2+)의 정성분석 [실험 목적] 수용액에서 금속의 산화-환원 반응과 침전 반응 등을 이용하여 Ag+, Cd2+, Pb2+, Hg2+을 정성분석하고 이를 통해 여러
devlawyer.tistory.com
5. [기구와 시약] 위 시약들의 물리적, 화학적 특성과 그 위험성에 대해 조사하시오. (원자량, 녹는점, 끓는점 포함)
-기구
큐벳, 메스실린더(10 mL), 비커(100 mL), 스포이드, 고무마개, NEO-S2117 UV/vis spectrophothometer
-시약
1 mM Fe(NO3)3∙9H2O
0.02 M KSCN
1. Fe(NO3)3∙9H2O (질산 제2철, 구수화물, Ferric Nitrate Nonahydrate)
CAS No.: 7782-61-8
KE No.: 자료없음
물질성상: 고체
분자량: 404 g/mol
녹는점: 자료없음
끓는점: 212 ℃
인화점: 125 ℃
유해위험 문구
- 위험 등급: 자료없음
- 누출을 멈추시오.
- 화재를 강렬하게 함: 산화제
- 적절한 보호의를 착용하지 않고 파손된 용기나 누출물에 손대지 마시오.
응급조치요령
- 피해야 할 물질 및 조건에 유의하시오.
- 눈에 들어갔을 때: 긴급 의료조치를 받으시오. 물질과 접촉 시 즉시 20분 이상 흐르는 물에 피부와 눈을 씻어내시오.
- 피부에 접촉했을 때: 긴급 의료조치를 받으시오. 오염된 옷과 신발을 제거하고 오염지역을 격리하시오.
- 흡입했을 때: 신선한 공기가 있는 곳으로 옮기시오. 호흡이 힘들 경우 산소를 공급하시오. 따뜻하게 하고 안정되게 해주시오.
- 먹었을 때: 긴급 의료조치를 받으시오. 밀폐공간에서는 공기공급식 송기 마스크 착용.
저장방법
- 열·스파크·화염·고열로부터 멀리하시오
- 금연.
- 의복 및 가연성 물질로부터 격리 및 보관하시오.
누출 및 폭발·화재 사고시 대처방법
- 누출물을 가연성 물질로부터 멀리하시오.
- 모든 점화원을 제거하시오.
- 용기에 물이 들어가지 않도록 하시오.
법적규제현황
- 노출기준: 자료없음.
- 특수건강진단주기: 자료없음.
- 작업환경측정주기: 자료없음.
- 화학물질관리법에 의한 규제: 자료없음.
- 위험물안전관리법에 의한 규제: 자료없음.
취급시 주의사항
- 개인 보호구 착용.
- 배기설비 가동 / 용기 밀폐.
- 금연 화기 엄금.
- 호흡하지 않는 경우 인공호흡을 실시하시오.
기타. 중독사례 - 자료없음.
2. 물질명 KSCN, 싸이오사이안산 칼륨 (Potassium Thiocyanate)
CAS 번호 333-20-0
KE 번호 KE-29216
물질성상 흡습성 고체
분자량 97.181 g/mol
끓는점 500 ℃
녹는점 173 ℃
인화점 자료없음
주요용도 인공양념, 살균제, 살충제 생산
물질명(CAS No.)
싸이오사이안산 칼륨 333-20-0
함유량(%) 100%
피해야 할 조건 및 물질
가연성 물질, 환원성 물질
유해위험 문구
- 삼키면 유해함
- 피부에 자극을 일으킴
- 눈에 심한 자극을 일으킴
- 졸음 또는 현기증을 일으킬 수 있음
- 태아 또는 생식능력에 손상을 일으킬 것으로 의심됨
- 장기(영향을 받는 것으로 알려진 모든 장기를 명시함)에 손상을 일으킬 수 있음 (장기독성)
법적규제현황
- 노출기준: 자료없음
- 특수건강진단주기: 자료없음
- 작업환경측정주기: 자료없음
- 산업안전보건법에 의한 규제: 자료없음
- 화학물질관리법에 의한 규제: 자료없음
- 위험물안전관리법에 의한 규제: 자료없음
취급시 주의사항
- 개인 보호구 착용
- 배기설비 가동 / 용기 밀폐
- 금연 화기 엄금
- 먹었을 때: 인공호흡을 하지 말고 적절한 호흡의료장비 이용
기타. 중독사례
- 노출되거나 노출이 우려되면 의학적인 조치 및 조언 구하기
출처 MSDS 물질 검색, Fe(NO3)3∙9H2O, KSCN
6. [실험 방법] 실험의 간략한 과정은 다음과 같다.
실험에 관련된 반응식은 다음과 같다.
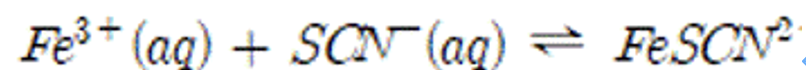
실험을 진행하고 계산한 이온들의 농도가 다음과 같을 때, 평형상수(K) 값을 계산하시오.
([Fe3+] = 1.5 X 10-2 M / [SCN-] = 8.4 X 10-5 M / [FeSCN2+] = 1.7 X 10-4 M)
(이때 유효숫자는 2자리로 계산할 것)
(답안 예시 : 5.6E+06 )
1. 혼합용액을 준비한다.
① 준비된 비커에 번호를 매기고, 아래 표에 따라 시약을 투입하고 흔들어 섞어준다.
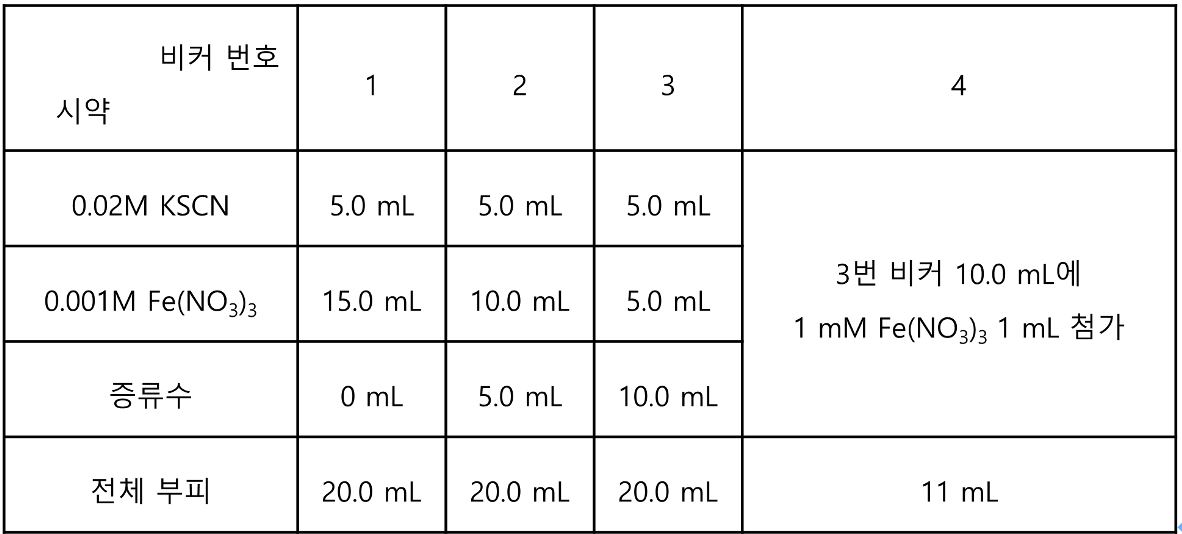
2. Le Chtalier 원리를 확인한다. (4번 비커)
① 3번 비커의 용액 10 Ml에 메스실린더로 측정하여 넣은 뒤 Fe(NO3)3 수용액 1mL를 메스실린더로 측정하여 넣은 뒤 비커를 흔들어준다.
② Fe(NO3)3 수용액 1mL를 첨가하기 전과 후의 색을 비교한다.
(관찰 및 결과분석 1번에 기록)
③ 위의 혼합용액의 흡광도를 측정한다.
3. 혼합용액의 흡광도를 측정하여 평형농도를 구한다.
① UV-VIS Spectrophotometer의 전원을 켜고 30분간 예열한다. 이 때 기기 안에 큐벳이 없어야 한다.
② self-check / Select BW에서 2 nm로 자가 점검을 한다.
③ 노브를 돌려서 Photometric을 선택한 후 Measure Mode가 Abs이고, 파장을 450 nm으로 설정한다. 이 때 파장 수(WL Num: Wave Length Number)가 1인지 확인한다.
④ 증류수를 넣은 큐벳을 넣은 후 뚜껑을 닫고 Autozero를 눌러 Calibration 한다.
⑤ 큐벳의 증류수를 버리고 1번 비커의 용액부터 순서대로 큐벳에 넣어 흡광도를 측정한다.
6-A.
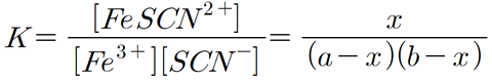
([Fe3+] = 1.5 X 10-2 M / [SCN-] = 8.4 X 10-5 M / [FeSCN2+] = 1.7 X 10-4 M)
(이때 유효숫자는 2자리로 계산할 것)
위에 있는 수치를 그대로 넣으면
1.3 X 10^2
이 나온다
'일반화학실험 > 화학및 실험2(실험)' 카테고리의 다른 글
| [화학및 실험2] 5주차 예비보고서, 식초와 아스피린의 정량분석 (1) | 2024.01.18 |
|---|---|
| [화학및 실험2] 4주차 결과보고서, 평형상수의 결정와 Le Chatelier 원리 확인 (1) | 2024.01.16 |
| [화학및 실험2] 3주차 결과보고서, 화학 반응 속도(시계반응) (2) | 2024.01.01 |
| [화학및 실험2] 3주차 예비보고서, 화학 반응 속도(시계반응) (0) | 2023.12.24 |
| [화학및 실험2] 2주차 결과보고서, 사이클로헥세인의 어는점 내림을 이용한 분자량 측정 (0) | 2023.12.17 |



