[실험 제목]
식초와 아스피린의 정량분석
[실험 목적]
- 몰농도(M), 산, 염기의 개념을 이해하고, 식초의 아세트산과 아스피린의 아세틸살리실산을 정량 분석한다.
- 산, 염기 적정을 통해 식초 중 아세트산의 함량과 두통약 아스피린 중 아세틸살리실산의 함량을 실험적으로 알아본다.
[실험 이론]
다음 실험 이론을 조사하시오.
1. 산과 염기의 개념(Arrehenius, Brønsted-Lowry, Lewis의 정의)에 대해 설명하시오.
1-1. Arrhenius산과 염기
1830년까지 '모든 산이 수소를 포함하지만, 수소를 포함하는 모든 물질이 산은 아니다.' 라는 것이잘 알려져 있었다. 1880년대에 스웨덴의 화학자 SvanteArthenius(1859~1927)는 산을 수용액에서 H이온을 생성하는 물질로, 염기를 수용액에서 OH-이온을 생성하는 물질로 정의 하였다. 시간이 지나면서 Arrhenius의 산 -염기 개념은 다음과 같이 정리되었다.
•산(acid)이란 물에 녹아서 H+이온의 농도를 증가시키는 물질이다.
•염기(605e)란 물에 녹아서 OH-이온의 농도를 증가시키는 물질이다.
물에 매우 잘 용해되는 염화수소기체는 Arthenius산의 한 예이다. 물에 녹으면 다음과 같이 H+와 CI-이온을 형성한다.
HCI(g) → H+(aq)+ CI-(aq)
수용액은 염산(hydrochloricacid)으로 알려져 있다. 진한 염산의 농도는 질량으로 약 37%이고 12M이다. 수산화소듐(NaOH)은 Arhenius염기이다. NaOH는 이온 결합화합물이기 때문에 물에 녹아서 Na+ 와 Cl-이온으로 해리되고, Cl-이온의 농도를 증가시킨다.
1-2. 브뢴스테드-로우리 산과 염기
브뢴스테드와 로우리가 제시한 방법으로 양성자(수소이온 H⁺)를 내놓는 물질은 산, 양성자(수소이온 H⁺)를 받는 물질을 염기라 정의하였다. 이때, 전자를 양성자 주개(proton donor) 후자를 양성자 받개(proton acceptor)라 부른다.
HA+B⟶HB+A
예컨대 위와 같은 식의 경우 HA를 산, B를 염기라 한다. 마지막으로 이때 산과 염기의 관계를 짝산 짝염기 관계라고 하는데 이는 '짝산 ↔ 짝염기 + H⁺'의 관계를 가지는 물질이라고 말할 수 있으며 이 경우 HA와 B의 관계이다.
이론이 생기게 된 배경
아레니우스 정의가 효율적이라 할지라도 그 범위 내에서는 정의할 수 없는 경우들이 있다. 아래와 같은 경우가 있다.
CH3COOH + H2O⟶CH3COO−+H3O+
CH3COOH+NH3⟶CH3COO−+NH4+
첫 번째 경우 아레니우스 산 염기 정의로도 브뢴스테드-로우리 염기 정의 모두로 아세트산이 산임을 쉽게 알 수 있다. 하지만 두 번째 경우를 보면, 반응을 통해 하이드로늄 이온(hydronium ion)이 발생하지 않았으므로 이를 아레니우스 산이라 부를 수는 없다. 이와 같이 비 수용성 용액에서의 반응이나 기체상에서 나타나는 반응에 대해서는 아레니우스 산 염기 정의를 통해 설명할 수 없다. 따라서 브뢴스테드-로우리 산 염기 정의를 도입하여 위와 같은 문제를 해결하였다.
1-3. 루이스 산과 염기
1923년, 미국의 화학자 길버트 뉴턴 루이스는 양성자(H+)와 수산이온(OH-)의 반응을 새로운 관점으로 바라볼 것을 주장하였다. 수산이온은 비공유 전자쌍 3쌍을 가지고 있는데, 양성자는 전자쌍 한 쌍을 받으며 수산이온과 결합을 한다. 루이스는 이렇게 결합을 하기 위해 전자쌍을 받는 물질을 산이라 정의하였다. 이 정의는 수소이온이 들어있지 않은 다른 반응에서도 쓰일 수 있다.
배위결합
이때 루이스 산과 루이스 염기가 형성하는 결합을 배위 결합 또는 배위 공유결합이라고한다. 배위 공유결합이란 두 원자가 공유 결합을 할 때 공유전자쌍이 한 쪽의 원자에서 유래하여 결합된 경우를 말한다. 예시는 다음과 같다.
BF3+NH3
한편 금속이온은 전자가 부족하며, 원자가 오비탈이 비어있기에 대게 루이스 산으로 작용한다. 이때 금속이온(루이스 산)과 루이스 염기가 결합하여 착이온을 형성한다.
양성자의 유무가 산의 정의에 핵심적인 요소였던 아레니우스 정의와, 브뢴스테드-로우리 정의와 달리, 루이스 정의는 반응 과정 중 전자쌍을 받는 모든 물질을 산이라 정의하여 산의 범위를 한층 넓혔다.
출처
브라운 일반화학 15판 p740~742
위키백과 검색어 '산(화학)' , '염기'
https://ko.wikipedia.org/wiki/%EC%82%B0_(%ED%99%94%ED%95%99)
산 (화학) - 위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. 산(酸, acid)은 일반적으로 물에 녹았을 때에 pH가 7보다 낮은 물질이다. 화학적으로는 물에 녹았을 때 이온화하여 수소 이온 H+을 내놓는 물질을 말한다. 산은 전
ko.wikipedia.org
https://ko.wikipedia.org/wiki/%EC%97%BC%EA%B8%B0
염기 - 위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. 이 문서는 산-염기의 염기에 관한 것입니다. 다른 뜻에 대해서는 핵염기 문서를 참고하십시오. 염기(鹽基, base)는 수용액에서 수산화 이온을 내거나[1] 수소 이
ko.wikipedia.org
2. 산과 염기의 적정에 대해 설명하시오.
2-1. 17.3 산-염기 적정

적정(utration)이라는 단어는 16세기 중반 프랑스에서 유래되었으며, 동전에서 금 또는은의 비율을 나타낸다. 이기술은 오늘날의 기기 분석에서 구식처럼 보일 수 있지만, 용액의 농도를 결정하는 정확하고 빠른 방법이 될 수 있다. 또한 적 정곡선을 그리면 분석물의 Ka 를 알 수있으며 곡선의 모양은 산/염기가 약하거나 강한지를 알려준다. 이 절이 끝나면 다음 사항을 수행할 수있어야 한다.
•산염기 직 정곡선의 임의의 지점에서 pH계산하기
•적정곡선으로부터 일 양성자산이나 다양성자산의 pKa 예측하기적정이란 반응물에 다른 반응물을 서서히 첨가하는 과정이며, 그 과정에서 평형 농도가 모니터링된다. 다음과 같은 두가지 경우에 적정을 한다.
•반응물중 하나의 농도를 알아야 하는 경우
•반응의 평형상수를 알아야 하는 경우 산-염기 적정에서는 농도를 알고있는 염기용액을 산에서서히 첨가 한다. (또는 산을 염기에 첨가 한다). 산-염기 지시약은 적정의 당량점(equivalencepoint. 화학량론적으로 산과 염기가 함께 똑같은 양에도 달하는 점)의 신호로 사용할 수 있다. 또는 첨가한 적 정제(titran)의 부피에 대한 pH적정곡선(pH titrationcurve)으로 반응의 진행과정(그림 17.6)을 알아보기 위하여 pH미터를 사용할 수도 있다. 적 정곡선의 모양은 적정의 당량점을 결정할 수있게 한다. 적정곡선은 적절한 지시약을 선택할 수있게 하고, 적정할 약산의 시나 염기의 성를 구할 수있도록 한다. 적정곡선이 왜 어떤 특이한 모양을 갖는가를 이해하기 위해 다음 세종류의 적정곡선을 살펴봐야한다.
(1)강산 -강염기.
(2)약산 -강염기.
(3)다양성자산 -강염기. 약염기가 포함된 경우.
출처 브라운 일반화학 15판 p809
2-2. 산-염기 적정
pH 미터를 이용한 적정 실험
산(acid)의 수소 이온(H+)와 염기(base)의 수산화이온(OH-)은 반응할 때 1:1로 반응하여 물(H2O을 생성한다. 이를 중화반응이라고 하는데 농도를 알고 있는 산 또는 염기를 이용하여 모르는 염기 또는 산의 농도를 구하는 것이 산-염기 적정반응이다. 일반적으로 중화반응의 속도가 매우 빠르기 때문에 산-염기 지시약을 이용하여 변색반응을 통해 종말점을 육안으로 확인할 수 있게 실험을 진행한다.[5] 하지만 종말점은 아날로그적인 방식으로 구하기 때문에 당량점(중화점)이라고 보기는 어려워 정확한 측정을 위해 pH미터를 사용하기도 한다.
강산과 강염기가 반응하는 경우에는 중화점의 pH가 7에 가깝지만 약산과 강염기, 혹은 강산과 약염기가 반응하는 경우에 중화점의 pH는 7보다 크거나 작게 된다.
산 염기 실험의 종류 균형 화학 반응식 중화점의 pH
HCl NaOH 강산 + 강염기 HCl + NaOH → H₂O + NaCl pH 7
CH₃COOH NaOH 약산 + 강염기 CH₃COOH + NaOH → Na+ + H2O + CH3COO- pH 7 보다 큼
HCl CN- 강산 + 약염기 CN- + HCl → Cl- + HCN pH 7 보다 작음
CH₃COOH CN- 약산 + 약염기 CN- + CH3COOH ⇌ HCN + CH3COO- pH 7 보다 작음
출처 위키백과 검색어 '적정(과학)'
3. 산, 염기 적정에 사용되는 지시약 대해 설명하시오.
지시약
지시약 (indicator)이란 그렇게 많지 않은 양만 가지고 어떤 적정반응의 종말점(눈으로 확인했을 때 반응이 완결되는 시점)을 확인하기 위해 쓰이는 물질을 일컫는다. 주로 용액의 색의 변화를 기준으로 하여 종말점을 확인 한다. 색의 변화를 이용해 종말점을 확인하는 경우 당량점(이론상 반응이 완결되는 시점)을 기준으로 하여 지시약의 색변화가 심하게 나타나는 것을 쓴다. 지시약은 크게 두 경우에 쓰이는데, 산염기반응과 산화환원반응이다.
산-염기 지시약
산·염기 지시약은 용액의 pH를 검출하는데 쓰이는 화학 약품이다.
산과 염기 반응의 지시약의 경우 지시약 분자는 약한 유기산으로 산성형과 염기성형의 색이 다르다. 따라서 외부의 PH조건이 급격히 변하게 되면 지시약 분자는 산성형 혹은 염기성형으로 바뀌게 되며, 산성형과 염기성형의 색이 다르므로 종말점을 결정할 수 있는 것이다. 산염기반응의 지시약은 페놀프탈레인, 브로모페놀블루 용액, 메틸 오렌지, 메틸 레드, 페놀 레드, 브로모티몰블루 등이 있다.
대표적인 지시약
페놀프탈레인 - 염기만 구별할 수 있다. 염기성일 때 적색, 나머지는 무색을 띤다. 단, pH가 0 이하인 초강산 물질과 반응할 때는 주황색을 띠고 강염기와 반응할 때는 무색을 띤다.
티몰프탈레인 - 염기와 초강산만 구별할 수 있다. 염기성일 때 청색, 초강산성일 때 황색이 된다.
BTB용액 - 산, 중성, 염기 모두 구별할 수 있다. 산성에서는 황색, 중성에서는 녹색, 염기성에서는 청색을 띤다.
메틸 레드-산성만 구별할 수 있다. 메틸 오렌지보다 조금 더 높은 영역(pH 4.4~6.2)에서 변색된다. 산성과 중성 사이에서 변색된다. 대부분의 산성에서는 적색, 매우 약한 산성과 중성 및 염기성에서는 황색을 띤다.
메틸 오렌지 - 강산성만 구별할 수 있다. 강산성일 때 적색이고 약산성과 염기성, 그리고 중성일 때 황색이 된다.
리트머스 시험지 - 지시약은 아니지만 산염기를 구분하는데 이용할 수 있다. 빨간색 종이가 파란색이 되면 염기이고 파란색 종이가 빨간색이 되면 산성이다.
자주색 양배추 지시약 - 자주색 양배추 지시약은 산성 용액에 떨어트리면 붉은색, 염기성에 떨어트리면 초록과푸른색으로 변한다. 안토시아닌이 산성인지 염기성인지 구분 할 수 있다.
출처 위키백과 검색어 '지시약', '산염기 지시약'
https://ko.wikipedia.org/wiki/%EC%A7%80%EC%8B%9C%EC%95%BD
지시약 - 위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. 지시약 (指示藥, 영어: indicator)이란 그렇게 많지 않은 양만 가지고 어떤 적정반응의 종말점(눈으로 확인했을 때 반응이 완결되는 시점)을 확인하기 위해 쓰이는
ko.wikipedia.org
4. 당량, 당량점, 종말점에 대해 설명하시오.
당량, 화학용어사전
화학당량과 전기화학 당량의 동의어로 사용되는 경우가 많다. 그 밖에 열의 일당량 등도 있으므로 단순히 당량이란 표현은 가급적 피하는 것이 좋다.
출처 : [네이버 지식백과] 당량, 화학용어사전
https://terms.naver.com/entry.naver?docId=2281411&cid=60227&categoryId=60227
당량
전기 화학 당량, 열의 일당량, 화학 당량의 세 가지가 있는데, 보통 당량이라고 하면 화학 당량을 가리킨다. 이것은 원소의 당량, 산 및 염기의 당량, 산화제 및 환원제의 당량 3가지로 나누어진
terms.naver.com
화학당량[chemical equivalent ]
화학 반응성에 기초하여 정해진 원소(단체) 또는 화합물의 일정량. 단순히 당량이라고 하는 경우도 많다. 원소, 산 및 염기, 산화제 및 환원제의 당량이 있다.
① 원소의 당량:원자량/원자가에 상당하는 값.
② 산·염기의 당량:1mol의 H+ 또는 OH- 이온을 방출하는 산 또는 염기의 양 Eg의 E,
③ 산화제 또는 환원제의 당량:각각 1mol의 전자를 받아들이거나 방출하는 양을 Eg로 할 때, E의 수치를 이른다.
출처 : [네이버 지식백과] 화학당량 [chemical equivalent] (화학용어사전, 2011. 1. 15., 화학용어사전편찬회, 윤창주)
전기 화학 당량 [electrochemical equivalent]
전기 분해에서 1C의 전기량에 의해 석출되는 물질의 양. 단위는 [g/C]로 나타내는데, 수치가 너무 작으므로 보통 [mg/C] 또는 [g/Ah]를 사용한다. 전기 화학 당량은 화학 당량에 비례한다.
출처: [네이버 지식백과] 전기 화학 당량 [electrochemical equivalent (전자용어사전, 1995. 3. 1., 월간전자기술 편집위원회)
https://terms.naver.com/entry.naver?docId=2322504&cid=60227&categoryId=60227
화학 당량
화학 당량은 단순히 당량이라고도 불리고 있는데 원소의 당량, 산 및 염기의 당량, 산화제 및 환원제의 당량이 있다. 1) 원소의 당량 : 산소의 ½그램 원자(8.000g)와 화합하는 다른 원소의 그램수,
terms.naver.com
당량점과 종말점
어떤 적정에서 적정되는 물질의 성분과 적정하는 성분 사이의 화학량론적 반응이 완결되는 지점을 당량점이라 하고, 이 값은 이론값이므로 실제 적정에서는 이 지점을 알 수가 없다. 따라서 당량점에 관한 정보를 얻기 위하여 지시약을 사용하게 되는데, 적정의 과정에서 지시약의 색이 변해서 적정액의 투입을 중지하는 지점을 종말점이라 한다.
실험시 당량점과 종말점이 반드시 일치하는 것은 아니다. 당량점과 종말점과의 차이가 적정오차인데, 적정에서는 당량점과 종말점이 일치하는 것이 이상적이다. 종말점과 당량점의 차이가 실험값과 이론값의 차이가 되므로, 실험오차가 된다.
출처 [네이버 지식백과] 당량점 [equivalence point] (두산백과 두피디아, 두산백과)
https://terms.naver.com/search.naver?query=%EB%8B%B9%EB%9F%89%EC%A0%90&searchType=&dicType=&subject=
당량점 : 네이버 지식백과
terms.naver.com
5. [기구와 시약] 위 시약들의 물리적, 화학적 특성과 그 위험성에 대해 조사하시오. (원자량, 녹는점, 끓는점 포함)
- 기구
삼각플라스크(250 mL), 뷰렛(50 mL), 메스실린더(100, 10 mL), 스탠드, 시약수저, 부피플라스크(100 mL), 유리막대
- 시약
아세트산
아세틸살리실산
NaOH
페놀프탈레인
5-1. 아세트산
CAS No. 64-11-7
물리적 특성
무색, 휘발성 액체
냄새: 식초 냄새
원자량: 60.0528g/mol
밀도: 1.049 g/cm^3
비중: 1.049
끓는점: 118.15 °C
녹는점: 16.6 °C
화학적 특성
유기산, 카르복실산의 일종
염기와 반응하여 아세테이트염을 생성
위험성
피부에 접촉하면 화상을 입을 수 있음
눈에 접촉하면 자극을 줄 수 있음
흡입하면 호흡기 자극을 줄 수 있음
5-2. 아세틸살리실산
CAS No. 108-95-2
물리적 특성
무색 또는 백색 결정 또는 분말
냄새: 약한 아세트산 냄새
원자량: 180.1599g/mol
밀도: 1.44 g/cm^3
비중: 1.44
끓는점: 135-136 °C
녹는점: 150-152 °C
화학적 특성
유기산
살리실산의 아세틸 에스터
염기와 반응하여 아세틸살리실산염을 생성
위험성
위장관 자극을 줄 수 있음
과다 복용 시 사망에 이를 수 있음
5-3. NaOH
CAS No.1310-73-2
물리적 특성
무색, 고체
냄새: 염기성 냄새
원자량: 40.0000g/mol
밀도: 2.13 g/cm^3
비중: 2.13
끓는점: 1388 °C
녹는점: 318 °C
화학적 특성
강염기
수산화 이온을 생성
산과 반응하여 염을 생성
위험성
피부에 접촉하면 화상을 입을 수 있음
눈에 접촉하면 자극을 줄 수 있음
흡입하면 호흡기 자극을 줄 수 있음
5-4. 페놀프탈레인
CAS No. 120-82-1
물리적 특성
무색, 분말
냄새: 약한 꽃향기
원자량: 166.1238g/mol
밀도: 1.2 g/cm^3
비중: 1.2
끓는점: 290 °C
녹는점: 258 °C
화학적 특성
pH 지시약
pH 8.2~10.0에서 붉은색으로 변함
위험성
무해
사용 시 주의사항
시약을 다룰 때는 고글, 마스크, 장갑 등 보호 장비를 착용합니다.
시약을 취급할 때는 유리 용기를 사용하고, 화학 반응을 수행할 때는 환기가 잘 되는 곳에서 합니다.
시약을 폐기할 때는 적절한 방법으로 처리합니다.
응급처치
시약이 피부에 접촉하면 즉시 물로 씻어냅니다.
시약이 눈에 접촉하면 즉시 물로 씻어내고, 안과 의사의 진료를 받습니다.
시약을 흡입하면 즉시 신선한 공기를 마시고, 호흡이 곤란하면 병원으로 갑니다.
출처: MSDS 물질검색 '아세트산', 아세틸살리실산', 수산화나트륨', '페놀프탈레인'
6.[실험 방법]실험의 간략한 과정은 다음과 같다.
만일 아래와 같이 지시약 반응이 진행된다고 한다면, 그 용액의 pH를 구해보아라.
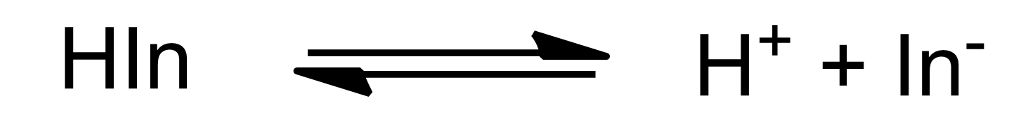
(pKa = 8.6, [ln-] : [Hln] = 1 : 100)
(이때 소수점 아래 첫째 자리 까지 구하여라)
(답안 예시 : 9.6)
실험A. 식초분석
① 100 mL의 1.0 M NaOH 표준용액을 만든다. 4.000 g의 NaOH (FW = 40 g)을 비커에 넣고 약 80 mL 증류수를 넣은 뒤 녹인다. 100 mL 부피 플라스크에 넣고 증류수를 표시선까지 채워서 흔들어 준다.
② 삼각 플라스크 무게를 측정한 뒤, 후드에 비치된 농도가 다른 사과 식초 2가지를 각각 10.0 mL씩 메스실린더로 취하여 삼각 플라스크에 넣고 무게를 잰다. (사용한 식초의 질량 측정 목적)
③ 40 mL의 증류수를 넣은 다음에 페놀프탈레인 지시약(1%) 5 방울을 넣는다.
④ 뷰렛에 1.0 M NaOH 표준용액을 넣고 한 번 흘려 내려 씻어준 후 적정을 한다. 분홍색이 30초 이상 지속된 후 없어지면 NaOH 한 방울을 더 넣어주고 종말점으로 간주한다.)
⑤ 반복실험을 한다. (전체 시행횟수 2회)
실험B. 아스피린 분석
① 아스피린 0.1 g을 250 mL 삼각 플라스크에 넣고 증류수를 100 mL을 넣은 뒤 계속 섞어준다. (최소 2~30 min) (기다리면서 실험 A를 진행한다.)
② 페놀프탈레인 지시약(1%) 5 방울을 넣는다.
③ 뷰렛에 만들어 둔 0.1 M NaOH 표준용액을 12~15 mL 넣고 조금 흘려 내려 씻어준 후 적정을 한다. (분홍색이 나타났을 때, 적정을 멈추고 30초 이상 섞는다. 분홍색이 사라지지 않는다면 해당 지점을 종말점으로 간주한다.)
④ 각 조별로 실험 B를 1번 진행하며, 같은 테이블의 다른 조와 결과를 공유한다. (계산할 때, 전체 시행횟수 2번이 되도록)
6-A.
지시약은 완충용액이다
핸더스 하셀 바흐식을 이용하면 된다.
pH = pKa + log ([A-]/[HA])
= 8.6 + log ( 1 / 100 )
= 8.6 - 2
= 6.6
답 6.6
'일반화학실험 > 화학및 실험2(실험)' 카테고리의 다른 글
| [화학및 실험2] 6주차 예비보고서, 비타 500에 들어있는 비타민 C 정량 분석 (2) | 2024.03.18 |
|---|---|
| [화학및 실험2] 5주차 결과보고서, 식초와 아스피린의 정량분석 (1) | 2024.03.16 |
| [화학및 실험2] 4주차 결과보고서, 평형상수의 결정와 Le Chatelier 원리 확인 (1) | 2024.01.16 |
| [화학및 실험2] 4주차 예비보고서, 평형상수의 결정와 Le Chatelier 원리 확인 (0) | 2024.01.16 |
| [화학및 실험2] 3주차 결과보고서, 화학 반응 속도(시계반응) (2) | 2024.01.01 |



