1. 실험 목적
: 반응용액의 흡광도를 측정하여 반응물과 생성물의 평형농도, 평형상수를 결정한다. 또한 이 반응에서 Le Chatelier 원리를 확인한다.
2. 실험 이론
1) 화학평형과 평형상수의 개념
2) Le chatelier의 원리
3) Lambert-Beer의 법칙
4) 착이온
(2-4주차 예비보고서에서 작성)
https://devlawyer.tistory.com/59
[화학및 실험2] 4주차 예비보고서, 평형상수의 결정와 Le Chatelier 원리 확인
[실험 목적] 반응용액의 흡광도를 측정하여 반응물과 생성물의 평형농도, 평형상수를 결정한다. 또한 이 반응에서 Le Chatelier 원리를 확인한다. [실험 이론] 다음 실험 이론을 조사하시오. 1. 화학
devlawyer.tistory.com
3. 실험 방법
1) 혼합용액을 준비한다.
① 준비된 비커에 번호를 매기고, 아래 표에 따라 시약을 투입하고 흔들어 섞어준다.
| 비커 번호 시약 |
1 | 2 | 3 | 4 |
| 0.001 M KSCN | 5.0 mL | 5.0 mL | 5.0 mL | 3번 비커 10.0 mL에 0.02 M Fe(NO3)3 1 mL 첨가 |
| 0.02M Fe(NO3)3 | 15.0 mL | 2.0 mL | 1.0 mL | |
| 증류수 | 0 mL | 13.0 mL | 14.0 mL | |
| 전체 부피 | 20.0 mL | 20.0 mL | 20.0 mL | 11 mL |
2) Le Chtalier 원리를 확인한다. (4번 비커)
① 3번 비커의 용액 10 mL를 메스실린더로 측정하여 넣은 뒤 0.02 M Fe(NO3)3 용액 1mL를 메스실린더로 측정하여 넣은 뒤 비커를 흔들어준다.
② 0.02 M Fe(NO3)3 용액 1mL를 첨가하기 전과 후의 색을 비교한다.
(관찰 및 결과분석 1번에 기록)
③ 위의 혼합용액의 흡광도를 측정한다.
3. 혼합용액의 흡광도를 측정하여 평형농도를 구한다.
① UV-VIS Spectrophotometer의 전원을 켜고 30분간 예열한다. 이 때 기기 안에 큐벳이 없어야 한다.
② self-check / Select BW에서 2 nm로 자가 점검을 한다.
③ 노브를 돌려서 Photometric을 선택한 후 Measure Mode가 Abs이고, 파장 수(WL Num: Wave Length Number)가 1인지 확인한 다음, 파장을 450 nm으로 설정한다.
④ 증류수를 넣은 큐벳을 넣은 후 뚜껑을 닫고 Autozero를 눌러 영점을 맞춘다.
⑤ 큐벳의 증류수를 버리고 1번 비커의 용액부터 순서대로 큐벳에 넣어 흡광도를 측정한다.
* 주의사항 *
큐벳을 사용할 때 투명한 부분을 손이나 다른 도구로 만지지 않도록 한다.
4. 기구와 시약
A) 기구
큐벳 4개, 메스실린더 10 mL 3개, 100 mL 비커 4개, 스포이드 3개, 고무마개, NEO-S2117 UV/VIS spectrophotometer
B) 시약 (분자량, 끓는점, 녹는점, 밀도, 위험성 조사)
0.02 M Fe(NO3)3•9H2O 용액, 0.001 M KSCN 용액, 증류수
| Safety Note |
| Fe(NO3)3•9H2O: 피부를 자극하여 산화시킬 수 있다. KSCN: 피부 발진 및 정신병을 유발할 수 있다. |
5. 실험 과정



FeCN2+ 짙은 붉은색수용액의 착이온(Amax = 447 nm)
Fe3+ 갈색~노란색수용색 임을 알고가자
1 → 2 → 3 으로 갈수록 연해짐을 육안으로 볼 수 있고
흡광도 관찰에서도 확인할 수 있다!!
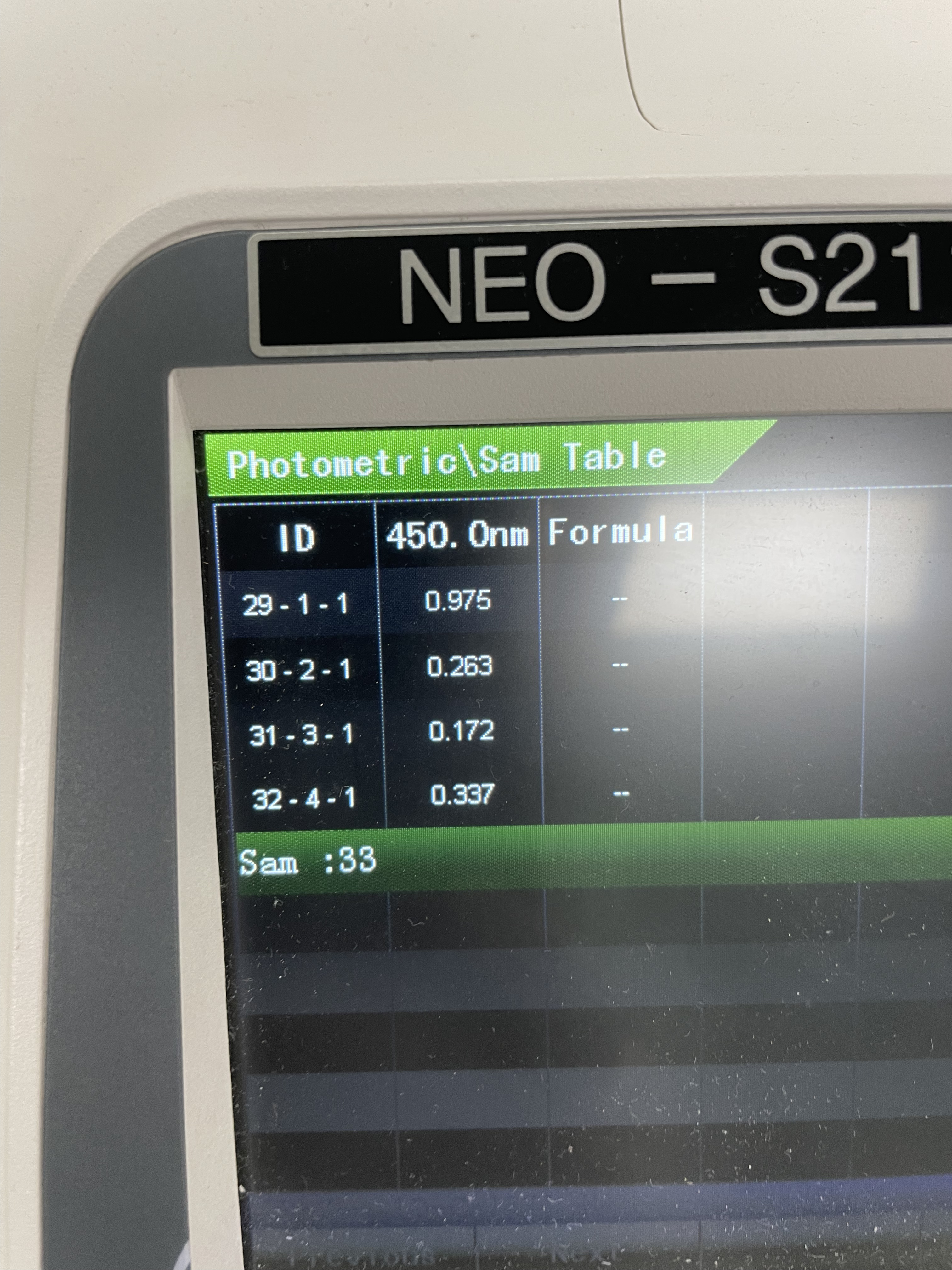
6. 실험 결과
6-1. 혼합용액의 초기농도와 흡광도 (계산 과정 포함)
| 1) | |||
| 비커 번호 | 혼합용액의 초기 농도 (M) |
흡광도 | |
| [Fe3+]초기 = a | [SCN-]초기 = b | A | |
| 1 | 0.015 | 0.00025 | 0.975 |
| 2 | 0.002 | 0.00025 | 0.263 |
| 3 | 0.001 | 0.00025 | 0.172 |
| 4 | 0.002727273 | 0.000227273 | 0.337 |
6-2.
| 2-a) | ||||
| K(평형상수) | 138 | |||
| 이차 방정식 | a | b | c | x |
| 138 | -3.1045 | 0.0005175 | 0.00016795 | |
| 138 | -1.3105 | 0.000069 | 5.2947E-05 | |
| 138 | -1.1725 | 0.0000345 | 2.9527E-05 | |
| 138 | -1.407727273 | 8.55372E-05 | 6.1129E-05 |
그래프를 그리면 기울기가 몰 흡광계수 이다.
| X축(농도) | 0.00016795 | 5.29469E-05 | 2.95269E-05 | 6.1129E-05 |
| Y축(흡광도) | 0.975 | 0.263 | 0.172 | 0.337 |
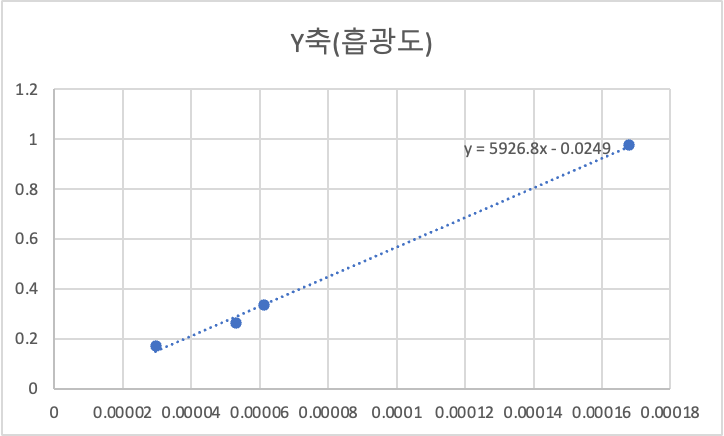
6- 2. 평형상태에서의 FeSCN2+ 농도 구하기 (계산 과정 포함)
빛을 흡수하는 FeSCN2+ 착이온이 녹아있는 용액의 흡광도는 Beer's rule을 따른다. 즉 혼합용액에 의하여 빛이 흡수되는 정도는 용액의 농도와 빛이 용액을 통과하는 거리의 곱에 비례한다
Beer's rule A= ebC.
e: 몰 흡광계수 (cm-1 x M-1)
b : 빛이 용액을 통과하는 거리 (cm)
C : sample 의 농도 (mol/L)
C = A / ( e x
b )
아래표는 위에 식에 데이터를 집어넣은 결과이다.
| 2-b) | |||
| A | 몰 흡광계수 | b | c |
| 0.975 | 5926 | 1 | 0.000164529 |
| 0.263 | 5926 | 1 | 4.43807E-05 |
| 0.172 | 5926 | 1 | 2.90246E-05 |
| 0.337 | 5926 | 1 | 5.6868E-05 |
6- 3. 혼합용액의 평형농도와 평형상수
6-2에서 구한 평형상태에서의 Fe3+, SCN-, FeSCN2+ 농도를 이용하여 아래의 표를 완성하고, 이를 통해 평형상수, K 를 구한다. (계산 과정 포함)
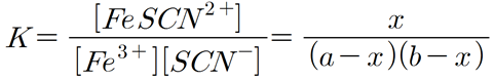
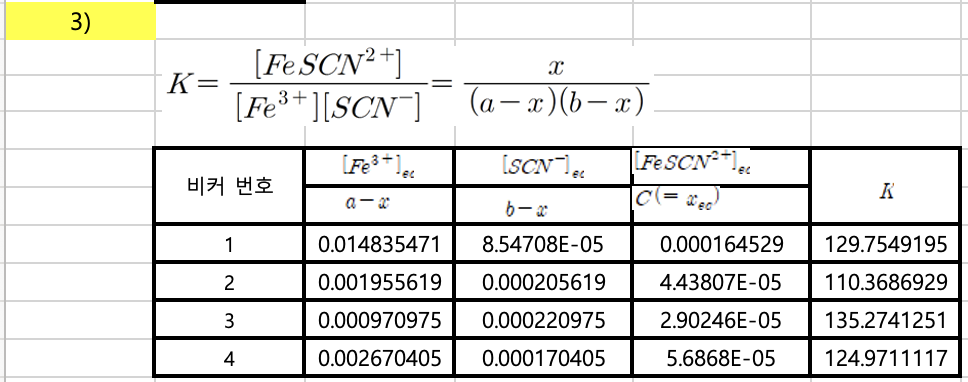
평형상태에서의 FeSCN2+ 농도 구하기표를 통해서 c (=x_equilibrium)를 구하고
Fe3+ + SCN- <=> FeSCN2+ 에서 평형상수K는
K = [FeSCN2+] / [Fe3+] [SCN-]
= c / (a - x) ( b - x)
비커 번호 a-x b-x c K
1 0.0148 8.55E-05 0.000165 129
2 0.00196 0.000206 4.45E-05 110
3 0.000971 0.000221 2.90E-05 135
4. 0.00267 0.000170 5.69E-05 124
7. 관찰과 결과분석
7-1. 3번 혼합용액에 0.001M Fe(NO3)3 용액 1 mL를 첨가하기 전과 후의 색 변화를 기록하고, Le Chatelier 원리를 이용하여 흡광도의 변화를 설명하시오.
A.
3번은 약간 노랬는데
0.001M Fe(NO3)3 용액 1 mL을 넣은 4번용액은 약간 갈색으로 조금더 짙어졌다.
실제로 흡광도가 올라간 것으로 보아 전체적으로 농도가 진해졌다.
짙은 붉은색수용액의 착이온(Amax = 447 nm)인 FeCN2+과
수용액에서 갈색~노란색인 Fe3+ 인 것을 알고 관찰해도 혼합용액의 색깔을 보아 둘의 농도가 진해진 것을 확인할 수 있다.
Le Chatelier 원리 관점에서는 평형을 유지하고 있던 3번용액에서
Fe3+ + SCN- <=> FeSCN2+
Fe3+를 더 첨가하여 반응지수가 Q<K 인 상태를 만들어 정반응이 우세한 반응으로 만들어 평형을 이동하였다(평형상수는 온도를 바꾸지 않아 바뀌지 않는다)
시간이 충분히 지나서 새로운 평형상태에 도달하게 되는데 그때의 Fe3+와 FeSCN2+ 농도 둘다 전의 평형상태보다 짙어져서 흡광도가 높게 관찰된다.
8. 후기
8-1. 흡광도 계산이 분석화학의 내용이긴 하지만 일반화학에서도 필요한내용이고 이해하면 계산할 것이 많지 않아 이해하기 어렵지 않다.
8-2. 분석화학책을 겸사겸사 펼치보니 아는내용이 생각보다 너무 많아서 배울 때 괜찮을 듯?
'일반화학실험 > 화학및 실험2(실험)' 카테고리의 다른 글
| [화학및 실험2] 5주차 결과보고서, 식초와 아스피린의 정량분석 (1) | 2024.03.16 |
|---|---|
| [화학및 실험2] 5주차 예비보고서, 식초와 아스피린의 정량분석 (1) | 2024.01.18 |
| [화학및 실험2] 4주차 예비보고서, 평형상수의 결정와 Le Chatelier 원리 확인 (0) | 2024.01.16 |
| [화학및 실험2] 3주차 결과보고서, 화학 반응 속도(시계반응) (2) | 2024.01.01 |
| [화학및 실험2] 3주차 예비보고서, 화학 반응 속도(시계반응) (0) | 2023.12.24 |



