1. 실험 목적
: 반응 물질의 농도를 달리하여 시계반응으로 속도를 측정하고, 반응속도 상수와 반응차수를 구한다.
2. 실험 이론
1) 반응 속도
2) 반응 속도 상수와 반응 차수
3) 반응 속도에 영향을 주는 인자
(2-3주차 예비보고서에서 작성)
https://devlawyer.tistory.com/57
[화학및 실험2] 3주차 예비보고서, 화학 반응 속도(시계반응)
[실험 제목] 화학 반응 속도 (시계반응) [실험 목적] 반응 물질의 농도를 달리하여 시계반응으로 속도를 측정하고, 반응속도 상수와 반응 차수를 구한다. [실험 이론] 다음 실험 이론을 조사하시
devlawyer.tistory.com
<시계 반응의 개념> 중요!!!
이번 실험은 화학양론적으로 다음과 같다.
2 I- + S2O82- → I2 (aq) + 2SO42-
이 반응은 동시에 세 가지 이온의 충돌이 필요하다. 그러한 충돌이 일어날 확률은 매우 작다.
첫째로 2개 아이오딘 이온과 1개 과황산(S2O82-) 이온간의 가능한 순차 반응은 다음과 같다.
메커니즘1 1-a I- + S2O82- → SO42- + SO4I-
1-b SO4I- + I- → I2 + SO42-
이 반응 중 한가지는 다른 반응보다 더 느리다. 다단계 반응 중 더 느린 반응을 속도 결정단계라고 한다. 이것은 그 과정의 전체 속도가 느린 단계의 속도에 따라 결정된다는 것을 의미한다. 메커니즘 1에서 첫째 단계가 속도 결정 단계이면 첫째 단계의 속도는 다음과 같다.
속도 = k [I-][S2O82-] (메커니즘 1-a의 속도식)
둘째 단계가 첫째 단계보다 느리면 속도식은 그 반응이 마치 한 단계로 일어나는 것과 같은 형태로 나타낸다.
속도 = k[I-]2[S2O82-] (메카니즘 1-b의 속도식이고 1단계 반응은 불가능하다.)
둘째로 가능한 순차 반응은
메커니즘 2 2-a 2 I- → I22-
2-b I22- + S2O82- → I2(aq) + 2 SO42-
첫째 단계가 속도결정단계이면
속도 = k[I-]2 (메카니즘 2-a의 속도식)
둘째 단계가 속도결정단계이면 속도식은 그 반응이 마치 1단계로 일어나는 것과 같다.
속도 = k[I-]2[S2O82-] (메카니즘 2-b의 속도식)
시계반응은 반응의 종말점을 쉽게 알 수 있도록 고안된 반응으로, 위의 실험 대상 반응에서 생성된 I2와 S2O32-의 반응이 동일 용기 내에서 동시에 일어나도록 한다.
I2 + 2 S2O32- → 2 I- + S4O62-
이 반응에서 I2가 형성되자마자 S2O32- 이온과 매우 빨리 반응하여 없어지고 S2O32- 이온이 모두 소모되면 I2 분자가 용액에 남게 되며, 이것이 녹말과 반응하여 청색을 띠게 된다. 따라서 S2O32- 이온이 모두 반응하여 없어지는데 필요한 시간을 색깔로 알려주므로 시계와 같은 구실을 한다.
I2 + 녹말 → blue complex
본 실험에서 결정하려는 반응 속도식은 다음의 첫 번째 반응에 관한 것이며,
2 I- + S2O82- → I2 + 2 SO42-
Na2S2O3 가 다 소모될 때까지, 즉 I2가 반응 용기에 존재하기 시작하는 순간까지의 반응 속도를 측정하는 것이다.
3. 실험방법
다음 표와 같이 시약을 넣고 (0.100 M 과산화 이황산 칼륨 용액 (K2S2O8)은 맨 나중에 첨가한다) 시험관을 고무 마개로 막은 후 투명한 색이 약간 누렇게 변하다가 청색이 되기 시작할 때까지의 시간을 재서 기록하도록 한다. (누런색을 바로 지나 청색이 된다)
<실험 SET>
| 시험관 번호 | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 0.200 M KI (mL) | 0.5 | 1.0 | 1.5 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 |
| 0.200 M KCl (mL) | 1.5 | 1.0 | 0.5 | |||||
| 0.100 M K2SO4 (mL) | 1.5 | 1.0 | 0.5 | |||||
| 0.100 M CuSO4 | 2 방울 |
|||||||
| 증류수 | ||||||||
| 0.4 % 녹말 용액중의 0.0075 M Na2S2O3 (mL) | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| 0.100 M K2S2O8 (mL) | 2.0 | 2.0 | 2.0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.0 |
4. 기구와 시약
A) 기구
눈금실린더 (10 mL), 초시계, 스포이드, 씻기병, 고무마개, 시험관, 시험관대
B) 시약 (분자량, 끓는점, 녹는점, 밀도, 위험성 조사)
0.200 M 요오드화 칼륨 용액 (KI),
0.200 M 염화 칼륨 용액 (KCl)
0.100 M 과산화이황산 칼륨 용액 (K2S2O8)
0.0075 M 티오황산 나트륨 용액 (Na2S2O3)
0.100 M 황산 칼륨 용액 (K2SO4)
0.4 % 녹말 용액
0.100 M CuSO4 용액
5. 실험 과정





6. 실험 결과
6-1-1) 다음 표를 채우시오.(농도 계산 과정 필수)
| 6-1) | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| t(sec) | 239.3 | 101.59 | 61.37 | 213.24 | 93.38 | 60.53 | 44.55 | 6.43 |
| 상대속도 (Sec^-1) |
0.00417885 | 0.00984349 | 0.01629461 | 0.00468955 | 0.01070893 | 0.01652073 | 0.02244669 | 0.155521 |
| [I-] | 0.02 | 0.04 | 0.06 | 0.08 | 0.08 | 0.08 | 0.08 | 0.08 |
| [S2O82-] | 0.04 | 0.04 | 0.04 | 0.01 | 0.02 | 0.03 | 0.04 | 0.04 |
6-1-2) 위 표의 (1), (2)의 [I-], [S2O82-]의 농도를 구하기 위한 풀이과정을 서술하시오.
몰농도는
M = mol / L
= mmol / mL 이다.
[I-] = (0.200M x 0.5mL) / (0.5+1.5+1+2)mL
[S2O82-] = (0.100M x 2mL) / (0.5+1.5+1+2)mL
6-1-3)
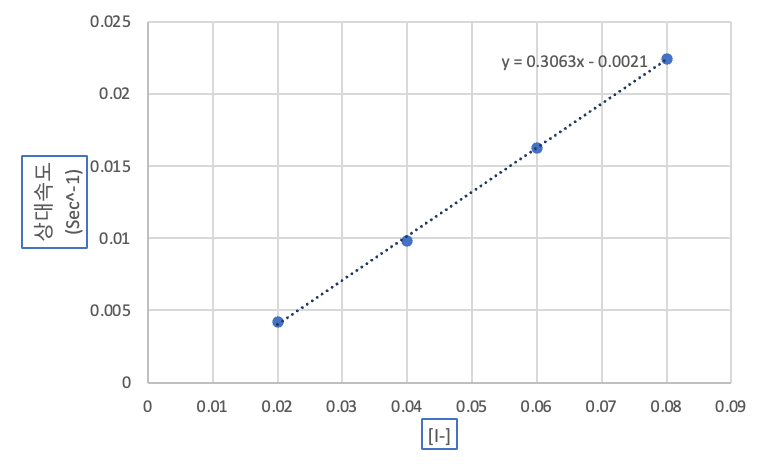
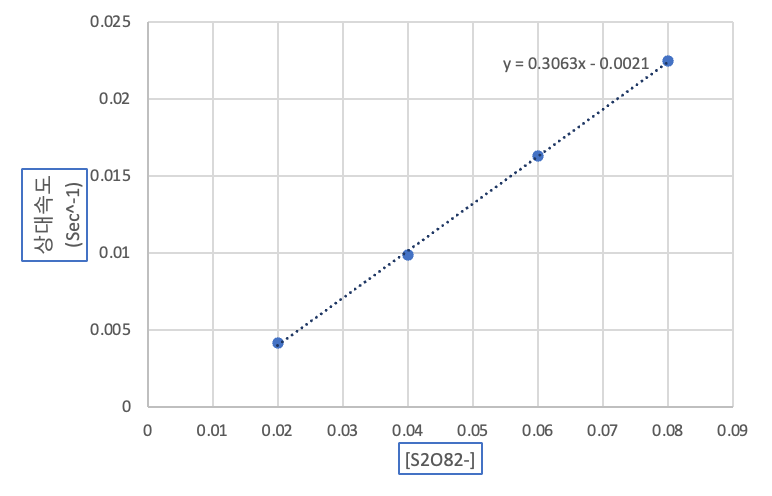
(1) 1,2,3,7 시험관의 I-의 농도에 따른 상대 속도
(2) 4,5,6,7 시험관의 S2O82-의 농도에 따른 상대 속도 그래프
위에 주어진 (1), (2) 그래프를 각각 엑셀을 이용해 그리고 하나의 pdf 파일로 만들어 과제란에 제출하시오.
6-2-1) 각각의 실험에서의 반응 차수를 구하여 평균값을 구하시오. (계산과정 반드시 쓸 것)
| 6-2-1) | ||||||
| 시험관번호 | 7 & 1번 시험관 | 7 & 2번 시험관 | 7 & 3번 시험관 | 7 & 4번 시험관 | 7 & 5번 시험관 | 7 & 6번 시험관 |
| m & n 차수 | 1.21266153 | 1.18926106 | 1.11341301 | 1.12949038 | 1.06768816 | 1.06550594 |
| 평균 | m의 평균 | 1.17177853 | n의 평균 | 1.08756149 |
6-2-2) 위 표의 (1) 빈칸을 채우기 위한 풀이과정을 서술하시오.
(1)번식
V7 = k x [I-]^m x [S2O82-]^n
0.022446689 = k x (0.08)^m x (0.04)^n
(2)번식
V1 = k x [I-]^m x [S2O82-]^n
0.004178855 = k x (0.02)^m x (0.04)^n
(1)번식 / (2)번식
5.371492705 = 4^m
양변에 log4를 취해주면
log_4 (5.371492705) = m
m= 1.21266153
| 7&1 | v = | k | [I-]^m | [S2O82-]^n | 7&4 | v = | k | [I-]^m | [S2O82-]^n | |
| 1) | 0.02244669 | 0.08 | 0.04 | 1) | 0.02244669 | 0.08 | 0.04 | |||
| 2) | 0.00417885 | 0.02 | 0.04 | 2) | 0.00468955 | 0.08 | 0.01 | |||
| 1)/2) | 5.3714927 | 4^m | 1)/2) | 4.78653199 | 4^n | |||||
| m | 1.21266153 | m | 1.12949038 | |||||||
| 7&2 | v= | k | [I-]^m | [S2O82-]^n | 7&5 | v = | k | [I-]^m | [S2O82-]^n | |
| 1) | 0.02244669 | 0.08 | 0.04 | 1) | 0.02244669 | 0.08 | 0.04 | |||
| 2) | 0.00984349 | 0.04 | 0.04 | 2) | 0.01070893 | 0.08 | 0.02 | |||
| 1)/2) | 2.28035915 | 2^m | 1)/2) | 2.09607183 | 2^n | |||||
| m | 1.18926106 | m | 1.06768816 | |||||||
| 7&3 | v= | k | [I-]^m | [S2O82-]^n | 7&6 | v = | k | [I-]^m | [S2O82-]^n | |
| 1) | 0.02244669 | 0.08 | 0.04 | 1) | 0.02244669 | 0.08 | 0.04 | |||
| 2) | 0.01629461 | 0.06 | 0.04 | 2) | 0.01652073 | 0.08 | 0.03 | |||
| 1)/2) | 1.37755331 | (4/3)^m | 1)/2) | 1.35869809 | (4/3)^n | |||||
| m | 1.11341301 | m | 1.06550594 |
6-3-1) 위의 평균 값(m & n)을 이용하여 각 시험관반응의 속도상수를 기록하시오.
(계산과정 반드시 쓸 것) (m = 요오드 이온의 차수, n = 과황산이온의 차수 (S2O82-), k = 속도 상수)
| 3 | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| k' | 13.55874835 | 14.17655971 | 14.59236658 | 13.53910362 | 14.54842856 | 14.44073204 | 14.34939585 | 99.41922009 |
| v | 0.00417885 | 0.00984349 | 0.01629461 | 0.00468955 | 0.01070893 | 0.01652073 | 0.02244669 | 0.155521 |
| [I-]^m | 0.01021371 | 0.02301039 | 0.03700529 | 0.05183993 | 0.05183993 | 0.05183993 | 0.05183993 | 0.05183993 |
| [S2O82-]^n- | 0.03017549 | 0.03017549 | 0.03017549 | 0.00668155 | 0.01419926 | 0.02206865 | 0.03017549 | 0.03017549 |
6-3-2) 위 표의 (1) 빈칸을 채우기 위한 풀이과정을 서술하시오.
V= k' x [I-]^m x [S2O82-]^n
표2 에서 구한 m, n의 평균값을 사용해서 계산하면
0.004178855 = k' x (0.02)^1.171778534 x (0.04)^1.087561489
0.004178855 = k' x 0.010213708 x 0.030175487
k' = 13.55874835
7. 관찰과 결과 분석
7-1. 이 실험에서 KCl, K2SO4를 사용하는 이유는 무엇인가?
KCl,K2SO4를 사용하는 이유
반응 혼합물을 희석시킬 때(똑같은 양, 5 mL로 만들 때)
물 대신 KCI 용액을 사용하는데 이것은 반응 속도에 영향을 미치는 반응 혼합물의 K+이온 세기를 일정하게 유지하기 위함이다. (K+는 반응메커니즘에 포함되지 않는 이온이고, SO42-는 반응식의 중간체이다. 반응속도에서는 영향을 크게 주지는 않지만, 용액 자체의 평형에는 영향을 끼친다)
7-2. 실험 결과로 보아 황산구리 용액의 역할은 무엇인가?
정촉매
시험관 8에만 황산구리 용액을 2방울 넣었는데, 표 3을 확인해보면 다른 시험관들은 속도 상수가 13,14에 몰려있는데 비해
시험관8만 99정도로 매우 크게 나온다. m,n에 차수에 영향을 미치지 않고 속도가 매우 커졌다.
따라서 황산구리 용액은 반응 속도를 증가시키는 (활성화에너지를 낮춰주는) 정촉매이다.
7-3. 실험결과를 토대로 다단계 메커니즘 1, 2 중 실험에 해당하는 메커니즘을 쓰고 속도 결정단계를 찾으시오.
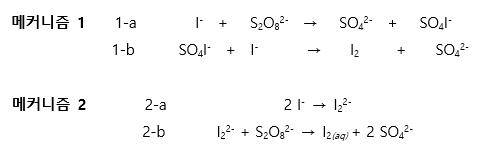
V=k x [I-]^m x[S2O82-]^n
에서 구한 평균 m, n값을 활용하면
V=k x [I-]^1.171 x[S2O82-]^1.088 이다
이식과 가장 유사한 매커니즘 속도식은
V=k[I-]^1 x [S2O82-]^1 이다.
메커니즘 1이 이번 실험에 해당하며 속도 결정단계는 1-a)이다 (1-b는 느린반응에 해당한다.)
8. 후기.
8-1. 시계반응이 확실히 이해하기 어렵다... (다른 시계반응들도 있으니 찾아보자!)
8-2. 이번주차 결과보고서는 그래프(6-1-3)도 그리고 쓸 것도 많고 ㅋㅋㅋ
뭐가 많은 주차다.
8-3.
'7. 관찰과 결과 분석' 이 파트는 중요한게 많아보인다 실험기말고사 전에 외우도록하자.

'일반화학실험 > 화학및 실험2(실험)' 카테고리의 다른 글
| [화학및 실험2] 4주차 결과보고서, 평형상수의 결정와 Le Chatelier 원리 확인 (1) | 2024.01.16 |
|---|---|
| [화학및 실험2] 4주차 예비보고서, 평형상수의 결정와 Le Chatelier 원리 확인 (0) | 2024.01.16 |
| [화학및 실험2] 3주차 예비보고서, 화학 반응 속도(시계반응) (0) | 2023.12.24 |
| [화학및 실험2] 2주차 결과보고서, 사이클로헥세인의 어는점 내림을 이용한 분자량 측정 (0) | 2023.12.17 |
| [화학및 실험2] 2주차 예비보고서, 사이클로헥세인의 어는점 내림을 이용한 분자량 측정 (2) | 2023.12.16 |



