[실험제목]
미지시료에 포함된 양이온(Ag+, Cd2+, Pb2+, Hg2+)의 정성분석
[실험 목적]
수용액에서 금속의 산화-환원 반응과 침전 반응 등을 이용하여 Ag+, Cd2+, Pb2+, Hg2+을 정성분석하고 이를 통해 여러 종류의 이온 평형을 이해한다.
[실험 이론]
다음 실험 이론을 조사하시오.
1. 정성 분석과 정량 분석에 대해 조사하시오
1-1. 정성분석 (qualitative analysis)
일반적으로 정량분석을 하기 전에 정성분석을 하게 된다. 물질을 구성하고 있는 화학종(예를 들면 원소 및 이온 등)이 가지는 특유한 반응 및 물리적 성질(예를 들면 스펙트럼 및 회전편광세기)을 이용해서 검출 및 확인한다. 정량분석에서와 같이 건식분석법과 습식분석법으로 크게 나눌 수 있다.
건식분석법은 용액을 사용하지 않고 고체 시약만을 사용하는 분석방법이며, 이와 반대로 습식분석법은 시료 및 시약을 수용액으로 만들어 분석하는 방법이다. 무기물질 중에 함유되어 있는 양이온의 검출에는 매우 조직적인 분석법이 수행되고 있다. 즉 양이온을 염산 및 황화수소 등의 시약을 사용하여 여섯 단계로 나누어서 침전시키고, 다시 같은 몇 종의 이온을 분리 ,확인함으로써 계통적으로 양이온을 검출한다. 음이온의 검출도 어느 정도 조직적으로 수행할 수 있으나 양이온의 검출에서와 같이 계통적이지는 못하다. 이 밖에 불꽃반응을 이용한 불꽃광도분석, 붕사구슬시험 및 인산염구슬시험을 이용하는 구슬반응, 크로마토그래피, 취관분석 및 분광분석 등도 비교적 널리 사용된다.
출처 : 네이버 지식백과(두산백과 두피디아, 두산백과) 검색어 '정성분석' qualitative analysis
1-2. 정량분석 (quantitative analysis)
요약 물질을 구성하는 양적 관계를 명확하게 하는 분석법의 총칭.
일반적으로 정성분석에 의해 물질을 구성하고 있는 성분을 알고 난 다음 정량분석이 행해진다. 분석방법에 의해 분류하면 물리화학적인 기계 ·기구를 사용해서 수행하는 기기분석과 화학반응을 이용해서 성분의 양을 결정하는 화학분석으로 크게 나누어진다. 기기분석은 조작이 간단해서 정밀도가 높고, 개인차가 적다.
이것에는 폴라로그래피 ,광흡수분석법 ,질량분석법 ,발광분광분석법 ,기체크로마토그래피와 같은 방법이 사용되고 있다. 화학분석은 조작법에 의해 분류하면 중량분석과 용량분석이 있다. 그리고 시료의 종류에 따라 분류하면 기체분석 ·미량분석이 있고, 그 방법에 의해 분류하면 비색분석, 비탁분석 및 전기분해분석 등이 있다.
2. 물에서 이온 결합 화합물의 용해도 규칙을 조사하시오.
이온 결합 화합물의 용해도 지침
불행하게도 이온 전하와 같은 간단한 물리적 성질만으로는 어떤 이온 결합 화합물이 용해될지 예측하기 어렵다. 그러나 실험적 관찰을 토대로한 지침을 통해서 이온 결합 화합물의 용해도를 어 느 정도 예측할 수 있다. 예를 들어 질산 음이온(nitrale anion, NO, )을 포함하는 모든 일반적인 이온 결합 화합물은 물에 잘 녹는다는 것이 실험적으로 알려져 있다. 표4.1은 일반적인 이온 결합화합물의 용해도 지침을 요약한 것이다.
표4.1 물에서 일반적인 이온 결합 화합물의 용해도 지침
가용성 이온 결합 화합물 불용성 이온 결합 화합물
화합물이 다음 이온을 포함할 때 화합물이 다음 이온을 포함할 때
NO3- S2-
CH3COO- CO32-
CI- PO43-
Br- OH-
SO42-
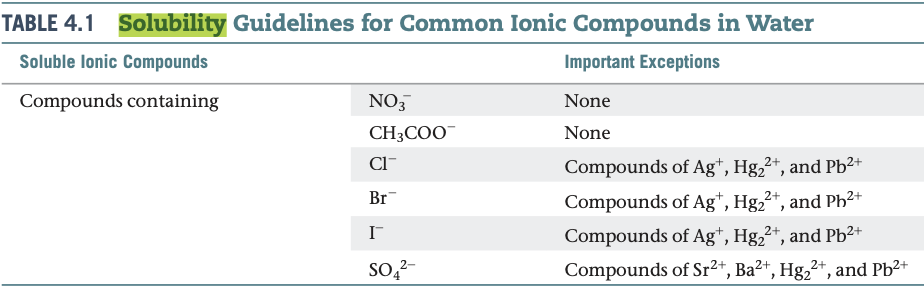
표에서는 화합물이 음이온에 따라 요약되어 있지만, 양 이온에 대해서도 많은 중요한 사실을 나타낸다. 모든 알칼리 금속 이온(주기율표의 1족)과 암모늄 이온(NH4+)을 포함하는 일반적인 이온 결합 화합물은 물에 잘 녹는다는 점에 주목하라.
두 가지의 강전해질 수용액을 섞었을 때, 침전물 생성 여부를 예측하는 방법
1. 반응물에 이온들이 존재하는지 주목한다.
2. 양이온-음이온 결합이 가능한지를 생각한다.
3. 표 4.1을 이용하여 결합한 화합물들이 불용성인지를 결정한다.
예를 들어 Mg(NO),와 NaOH 용액을 섞으면 침전물이 생성되는가? Mg(N03)2와 NaOH는 모 두 이온 결합 화합물이므로 모두 강전해질이다. Mg(NO3)2(aq)와 NaOH(aq)를 섞으면 우선 Mg2+ NO- . Na+, OH- 이온을 포함하는 용액이 생성된다. 어떤 양이온이 어떤 음이온과 상호 작용하 여 불용성 화합물을 만드는가? 표 4,1로부터 Mg(NO3)2,와 NaOH는 모두 물에 녹는 것을 알 수 있 으므로 Ng''와 Ot 의 반은 또는 NG'와 NO.의 반응만 가능하다. 표 4.1로부터 수산화물은 일 반적으로 불용성임을 알 수 있다. Mg? *도 예외가 아니므로 Mg(OH)2는 불용성, 즉 침전물이다.
그러나 NaNO3는 가용성이므로 Na+ 와 NO3- 이온은 용액에 남는다.
침전 반응의 균형 맞춘 반응식은 다음과 같다.
Mg(NO3)2(aq) + 2 NaOH(aq) - > Mg(OH) (s) + 2 NaNO3(aq)
3. 불균등화 반응에 대해 조사하시오.
3-1. 불균등화 반응(disproportionation) 또는 불균화 반응에는 두 종류가 있다.
2A → A' + A" 와 같은 형태로 일어나는 반응. 여기서 A, A', A"는 모두 다른 화학 물질이다. 이 중 대부분이 산화·환원 반응이지만, 2H2O → H3O+ + OH-처럼 산화,환원 반응이 아닌 것도 있다.
한 물질이 동시에 산화되고 환원되어 각각 다른 생성물을 만드는 반응.
이와 같은 반응이 역으로 일어나는 경우에는 역불균등화 반응(comproportionation)이라고 한다.
3-2. 역사
처음으로 자세한 연구가 이루어진 불균등화 반응은 다음과 같다.
2 Sn2+ → Sn + Sn4+
이 반응은 1788년, 핀란드의 화학자 요한 가돌린이 주석산염을 사용하여 확인한 것이다.
3-3. 불균등화 반응의 예
염소 가스는 묽은 수산화나트륨과 반응하여 염화나트륨, 염소산나트륨, 물을 생성한다. 이 반응의 반응식은 다음과 같다.
3Cl2 + 6OH− → 5Cl− + ClO3− + 3H2O
반응물에서 염소 원자의 산화수는 0이다. 생성물 중 Cl−의 산화수는 -1이며, 산화수가 감소했으므로 환원되었다. 반면에 염소산나트륨의 산화수는 +5로, 산화수가 증가하였다. 즉, 산화되었다.
과산화수소는 불균등화 반응을 통해 물과 산소로 분해된다. 이 반응은 카탈라아제 효소에 의해 촉진된다. 2H2O2 → 2H2O + O2
Boudouard 반응은 HiPco공정에서 탄소 나노튜브를 생산할 때 사용하는 불균등화 반응이다. 고압의 일산화탄소에 촉매를 첨가하면 다음과 같은 불균등화 반응이 일어난다. 2CO → C + CO2
출처: 위키백과 검색어 '불균등화 반응'
4. 착이온에 대해 조사하시오.
4-1. 착이온 (complex ion)
착물이 전하를 띠고 있을 때 착이온이라 한다. 착물이란 중심에 원자나 이온이 있고 그 주변에 여러 개의 다른 원자, 원자단, 이온, 분자 등이 입체적으로 배위하고 있어 하나의 원자집단이 된 물질을 의미한다. 착이온의 전하는 중심이온의 전하와 배위자의 전하를 합한 값이다. 예를 들어 [Co(NH3)6Cl2]+에서 중심이온인 코발트는 +3, 염화이온은 -1이다. 따라서 +3 + (-1) + (-1) = +1 이므로 전하는 +1이다.
출처: 사이언스 올 과학문화의 모든 것 검색어 '착이온'
4-2. 착이온이란?
착이온은 중심 금속 이온에 리간드가 결합하여 이루어진 이온을 말한다. 착이온에서 중심 금속 이온의 전하량은 착이온의 전하량에서 리간드의 총전하량을 뺀 값이다.
착이온은 중심 금속 이온에 리간드가 배위 결합하여 이루어진 복잡한 구조의 이온이다. 착이온은 배위수와 리간드의 종류에 따라 직선형, 정사면체형, 평면 사각형, 정팔면체 등의 기하학적 구조를 나타낸다.
착이온에서 중심 금속 이온의 전하량은 그 이온이 나타내는 전하량에서 리간드가 지니는 전하량을 모두 빼어 결정할 수 있다.
출처: 네이버 지식백과 검색어 '착이온 (complex ion)'
개인적으로 리간드도 그렇고
착이온이란 단어가 생소하여 좀 더 조사하게 되었습니다.
4-3. 여기서 리간드란?
일반화학 15판을 2권은 영문으로 구해서 영어로 작성하였습니다.
p847~848
Formation of Complex Ions
A characteristic property of metal ions is their ability to act as Lewis acids toward water molecules, which act as Lewis bases. Lewis bases other than water can also interact with metal ions, particularly transition-metal ions. Such interactions can dramatically affect the solubility of a metal salt.
For example, AgCl 1Ksp = 1.8 x 10-102 dissolves in the presence of aqueous ammonia because Ag+ interacts with the Lewis base NH3, as shown in Figure 17.19. This process can be viewed as the sum of two reactions:
AgCl(s) <-> Ag+1(aq) + Cl-(aq) [17.21]
Ag+(aq) + 2NH3(aq) <-> Ag(NH3)2+ Cl-(aq) [17.22]
Overall: AgCl(s) + 2 NH3(aq) <-> Ag(NH3)2+(aq) + Cl-(aq) [17.23]
The presence of NH3 drives the reaction, the dissolution of AgCl, to the right as Ag+(aq) is consumed to form Ag(NH3)2+, which is a very soluble species.
For a Lewis base such as NH3 to increase the solubility of a metal salt, the base must be able to interact more strongly with the metal ion than water does. In other words, the NH3 must displace solvating H2O molecules in order to form [Ag(NH3)2]+:
Ag+(aq) + 2NH3(aq) <-> Ag(NH3)2+
An assembly of a metal ion and the Lewis bases bonded to it, such as Ag(NH3)2+, is called a complex ion.
Complex ions are very soluble in water. The stability of a complex ion in aqueous solution can be judged by the size of the equilibrium constant for its formation from the hydrated metal ion.
5. 위 시약들의 물리적, 화학적 특성과 그 위험성에 대해 조사하시오. (몰질량, 녹는점, 끓는점 포함) (8개....)
시약
0.1M AgNO3
0.05M Hg(NO3)2
0.1M Pb(NO3)2
0.1M Cd(NO3)2
3M HCl
3M NH4OH
6M NaOH
0.5M SnCl2
미지시료 A&B
기구
시험관, 원심분리기
1. AgNO3 질산은 169.87g/mol 212 440
2. Hg(NO3)2 수은(II)질산염 24.7g/mol. 79 자료없음
3. Pb(NO3)2 질산납 331.2g/mol 470 83
4. Cd(NO3)2 질산카드뮴 236.42g/mol 360 31.9
5. HCl 염산 36.458g/mol 농도에 의존적 농도에 의존적
6. NH4OH 암모니아수 35.04g/mol -91.5 37.7
7. NaOH 수산화나트륨 39.997g/mol 318 1,388
8. SnCl2 염화제일주석 189.6g/mol 247 623
물리적 화학적, 위험성
은을 질산과 반응시켜 얻으며 반응식은 Ag + 2 HNO3 → AgNO3 + NO2 + H2O 이다.
알코올무수물,벤젠,아세톤 등에는 잘 녹지 않지만, 에테르·메탄올 등에는 약간 녹으며 물에 잘 녹는다. 순수한 질산은은 빛에 비교적 안정하며, 타타르산·수크로스·알데하이드 등과 반응하면 은이 환원되어 은이 석출되는 은거울반응이 일어난다. 할로겐 이온을 갖는 액체와 반응하면 할로겐화은 침전이 생긴다.(Ag+ (aq) + X− (aq) → AgX (s), X = Cl, Br, I). 과잉의 암모니아수를 가하면 [Ag(NH3)2]NO3라는 착염이 생긴다. 은을 산에 녹여서 증발시키면 무수물이 석출된다.
은거울반응 외에 브로민화은의 제조원료, 은 도금, 분석용 시약, 도자기의 착색, 상아 등의 부식제로서 사용된다. 단백질 응고작용이 있어 피부 등을 부식시킨다. 의약품으로서는 농도에 따라 부식·소독·살균·수렴의 작용을 보이며, 묽은 용액을 피부나 점막에 도포하여 사용한다. 보존할 때는 마개를 단단히 하여 어두운 곳에 둔다. 극약으로 치사량 10g이다.
출처: 네이버 지식백과 질산은 (silver nitrate)
위험성
화재를 강렬하게 함:산화제, 눈에 심한 손상을 일으킴, 흡입하면 치명적임
장기(영향을 받는 것으로 알려진 모든 장기를 명시한다.)에 손상을 일으킬 수 있음
수생생물에 매우 유독함, 장기적인 영향에 의해 수생생물에게 매우 유독함
출처: MSDS 검색 '질산은'
2. Hg(NO3)2 수은(II)질산염
수은 질산염은 수은과 질산이 결합하여 만들어진 화합물입니다. 화학식은 Hg(NO3)2이며, 무색의 결정성 고체로 존재합니다.
수은 질산염은 산화제로 작용하여, 산화 작용이 필요한 화학 반응에서 종종 사용됩니다. 예를 들어, 수은 질산염은 알코올과 반응하여 알데히드를 합성하는 반응에서 산화제로 작용합니다. 수은 질산염은 또한 금속 표면의 부식을 방지하기 위해 표면 처리에 사용되기도 합니다.
위험성
삼키면 치명적임, 피부와 접촉하면 치명적임, 흡입하면 치명적임
태아 또는 생식능력에 손상을 일으킬 수 있음
장기간 또는 반복노출 되면 장기(영향을 받는 것으로 알려진 모든장기를 명시한다.)에 손상을 일으킬 수 있음
수생생물에 매우 유독함, 장기적인 영향에 의해 수생생물에게 매우 유독함
출처: MSDS 검색 '질산수은(Ⅱ)'
3. Pb(NO3)2 질산납
질산 납(II)(Lead(II) nitrate)은 화학식 Pb(NO3)2을 갖는 무기 화합물이다. 무색 결정이거나 백색 고체로 보통 나타나지만 다른 납(II)염들과 달리 물에 녹는다.
질산 납(II)은 납 중독을 일으키며 흡입, 소화, 피부 접촉이 되지 않도록 주의깊게 관리해야 한다.
출처 위키백과 검색어 '질산 납(II)'
4. Cd(NO3)2 질산카드뮴
삼키면 유독함
피부와 접촉하면 유해함, 흡입하면 유해함, 유전적인 결함을 일으킬 수 있음
암을 일으킬 수 있음(암을 일으키는 노출 경로를 기재한다. 단, 다른 노출경로에 의해 암을 일으키지 않는다는 결정적인 증거가 있는 경 우에 한한다.)
태아 또는 생식능력에 손상을 일으킬 것으로 의심됨장기간 또는 반복노출 되면 장기에 손상을 일으킴
수생생물에 매우 유독함장기적인 영향에 의해 수생생물에게 매우 유독함
출처: MSDS 검색 '카드뮴 질산'
5. HCl 염산
고농도의 염산은 다량의 증기가 발생하며 이는 눈, 피부, 창자 등의 생체 조직에 손상을 입힐 수 있다. 또 염산을 과망가니즈산 칼륨이나 차아염소산나트륨 등에 섞으면 유독한 염소 기체가 생성된다.
염산 자체가 폭발하지는 않으나 염산에서 생성된 수소는 폭발할 수 있다. 이온화 경향이 큰 알칼리 금속이나 알칼리 토금속과 염산이 반응하면 금속이 부식해서 다음과 같은 반응이 일어난다.
이온화 경향이 큰 칼륨, 칼슘, 나트륨 등의 금속과 반응하면 수소기체가 많이 발생하고 온도가 높은 상황에는 폭발할 수도 있다.
출처 위키백과 검색어 '염산'
6. NH4OH 암모니아수
암모니아수에는 NH3 + H2O와 NH4OH 의 중간형태의 구조를 가진 분자가 존재한다고 여겨진다. 암모니아가 물에 녹으면서 다음과 같은 평형이 생성된다.
NH3 + H2O <->NH4+ + OH-
위 반응의 이온화 상수는 25도씨에서 1.77×10^-5이다.
NH3 + H2O분자는 암모니아 분자와 물 분자가 수소 결합으로 결합되어 있는 형태를 가진다. 암모니아수에는 2NH3 + H2O태의 분자도 존재한다
보관상의 주의
암모니아가 증발될 수 있고 공기 중에 존재하는 이산화 탄소 등의 산성 기체를 흡수하기 때문에 고무, 플라스틱, 유리 등의 마개로 막아서 보관하여야 한다. 온도 상승과 함께 암모니아의 분압이 상승하여 폭발할 수 있으므로 30도씨 이하의 찬 곳에서 보관해야 한다. 그 밖의 주의사항은 암모니아의 것을 따른다.
출처 위키백과 검색어' 암모니아수'
7. NaOH 수산화나트륨
수산화 나트륨(NaOH)은 물에 녹아 강염기성 수용액을 만든다. 식음료, 치약, 비누 등의 산업에서 널리 사용된다.화학 실험에서 가장 널리 사용되는 염기이며, 산업계에서는 흔히 가성소다라고 일컫는다.
순수한 수산화 나트륨은 대기 중에서 수증기와 이산화 탄소를 잘 흡수한다. 온도에 무관하게 물에 잘 녹으며 이 때 많은 열이 발생한다. 수산화 칼륨은 잘 녹지 않는 에탄올과 메탄올에도 녹는다. 에테르나 다른 무극성 용매에는 녹일 수 없다. 수산화 나트륨 수용액은 섬유와 종이에 노란색 얼룩을 남긴다.
안정성
수산화나트륨은 일상생활에서 중요한 계면활성제인 비누의 주요한 성분이다. 그러나 고체 수산화 나트륨이나 고농도의 수산화 나트륨 수용액은 피부에 심각한 수준의 화학적 화상을 유발할 수 있으며 영구적인 상흔이나 실명 등 인체에 부정적인 영향을 끼칠 수 있다.
알루미늄과 수산화 나트륨은 많은 수소 기체를 발생시킨다.
2Al(s) + 6NaOH(aq) → 3H2(g) + 2Na3AlO3(aq).
밀폐된 공간에서 수소 기체를 대량으로 발생시킬 경우 위험하다.
출처 위키백과 검색어' 수산화 나트륨'
8. SnCl2 염화제일주석
무색의 결정성 고체이며, 물에 녹는다.
SnCl2는 강한 환경 산화제와 반응하여 염소 가스를 방출할 수 있으므로 산화제와 함께 사용하면 위험할 수 있습니다. 또한, SnCl2는 피부, 눈, 호흡기에 자극을 일으키므로, 적절한 보호장비를 착용하고 작업장에서는 충분한 환기를 유지해야 합니다.
출처: MSDS 검색 '주석(II)염화물'
위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. 위키백과 우리 모두가 만들어가는 자유 백과사전문서 637,792개와 최근 기여자 1,796명 사랑방 다른 분들과 의견을 교환해봐요! 질문방 지침으로 해소되지 않는
ko.wikipedia.org
https://msds.kosha.or.kr/MSDSInfo/kcic/msdssearchMsds.do
안전보건공단 화학물질정보 | MSDS검색
본문내용 산업안전보건법 제110조 및 111조에 의거 유통되는 화학물질 및 화학물질을 함유한 제제의 물질안전보건자료(MSDS)는 해당 물질을 양도하거나 제공(제조·수입·판매자(도·소매업자))하
msds.kosha.or.kr
6. [실험 방법] 실험 과정은 다음과 같다. (빈칸 채우기~)
① Ag+, Cd2+, Pb2+, Hg2+ 금속 양이온이 모두 포함된 혼합용액 3ml를 시험관에 취한 후 3M HCl을 1ml 정도 스포이드로 가한 후 원심분리한다.
② 원심분리 한 용액에서 생긴 침전과 상층액을 나눈다.
③ ②번에서 분리한 침전에 3M NH4OH를 1ml 가한 후 잘 섞어주고 원심분리한다.
④ ③번과정에서 얻은 결과물의 상층액과 침전을 분리한 후 상층액에 3M HCl을 1ml 가한 후 침전을 확인한다.
⑤ ②번 과정에서 얻은 상층액에 0.5M SnCl2용액을 1ml 가한 후 원심분리하고 상층액과 침전을 분리한다.
⑥ ⑤번 과정에서 얻은 상층액에 6M NaOH를 1ml 가한 후 침전을 확인한다.
⑦ 실험 결과의 계통도를 채워보자
⑧ 미지시료 A와 B에 대해서 ①~⑦ 과정으로 실험하여 어떤 양이온이 들어있는지 알아본다.
7. 후기
7-1. 정성분석, 정량분석
뭔가 입시할때 정량, 정성이라는 단어를 쫌 써서 엄청 어색하지는 않지만
화학파트에서 듣다보니 신기함.
7-2. 불균등화
'한 물질이 동시에 산화되고 환원되어 각각 다른 생성물을 만드는 반응'
이렇게 설명들으니까 꼳히는듯.. (보고서때는 출처가 분명해야해서 옮기지 못함)
출처 (감사합니다)
https://ywpop.tistory.com/2970
산화-환원 반응에서 불균등화 반응 ★
산화-환원 반응에서 불균등화 반응(disproportionation) --------------------------------------------------- ▶ 한 물질이 동시에 산화되고 환원되어 각각 다른 생성물을 만드는 반응 ▶ 2A → A' + A" 와 같은 형태
ywpop.tistory.com
7-3. 착이온, 리간드
우리말로 하면 '배위자'
NH3, Cl-, NH2CH2COO- 등은 각각 중심 원자인 Co3+, Fe3+, Cu2+ 등과 결합된 이온 또는 분자로서 리간드가 되고 있다.
보고 이해한바에 따르면
NH3의 중간에 N이 비공유 전자쌍을 하나 가지고 있어서 이온들과 붙을수 있는데 이러한 배위결합하고 있는 NH3같은 분자나 이온들을 리간드라 하는 것 같다.
https://terms.naver.com/entry.naver?docId=605641&cid=42420&categoryId=42420
배위자
착물 중에서 중심 원자를 둘러싸고 배위결합하고 있는 이온 또는 분자를 이른다. 리간드라고도 한다. 예를 들면 [CO(NH3)6]Cl3, K3[FeCl6], [Cu(NH2CH2COO)2] 등에 있어서 NH3, Cl-, NH2CH2COO- 등은 각각 중심 원
terms.naver.com
출처
https://terms.naver.com/entry.naver?docId=1140545&cid=40942&categoryId=32255
정성분석
화학분석법 중에서 시료가 어떤 성분으로 구성되어 있는지 알아내기 위한 분석법의 총칭. 일반적으로 정량분석(定量分析)을 하기 전에 정성분석을 하게 된다. 물질을 구성하고 있는 화학종(化
terms.naver.com
https://terms.naver.com/entry.naver?docId=5662942&cid=62802&categoryId=62802
정량 분석
분석 화학에서 정량 분석(quantitative analysis)은 시료(sample)에 존재하는 특정 화학종, 혹은 여러 가지 화학종들의 절대적인 양 혹은 상대적인 양을 결정하는 것을 말한다. 이에 반해 정성 분석(qualita
terms.naver.com
https://ko.wikipedia.org/wiki/%EB%B6%88%EA%B7%A0%EB%93%B1%ED%99%94_%EB%B0%98%EC%9D%91
불균등화 반응 - 위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. 불균등화 반응(不均等化反應, 영어: disproportionation) 또는 불균화 반응(不均化反應)에는 두 종류가 있다.[1] 2A → A' + A" 와 같은 형태로 일어나는 반응. 여기서 A, A
ko.wikipedia.org
https://www.scienceall.com/%EC%B0%A9%EC%9D%B4%EC%98%A8complex-ion-2/
착이온(complex ion) | 과학문화포털 사이언스올
과학의 모든 것, 사이언스올! 과학학습, 과학체험, 과학문화 콘텐츠 제공
www.scienceall.com
'일반화학실험 > 화학및 실험1(실험)' 카테고리의 다른 글
| [화학및 실험1] 8주차 예비보고서, 미지시료에 포함된 음이온의 정성분석 (0) | 2023.06.20 |
|---|---|
| [화학및 실험1] 7주차 결과보고서, 미지시료에 포함된 양이온의 정성분석 (1) | 2023.06.19 |
| [화학및 실험1] 6주차 결과보고서, 주머니 난로의 열량 측정 (1) | 2023.06.18 |
| [화학및 실험1] 6주차 예비보고서, 주머니 난로의 열량 측정 (1) | 2023.06.17 |
| [화학및 실험1] 5주차 결과보고서, 금속의 활동도 서열 결정 (5) | 2023.06.16 |



