[실험 목적]
아보가드로의 법칙에 의하면 일정한 온도와 압력에서 같은 부피의 기체는 기체의 종류와 무관하게 같은 수의 분자가 들어 있다고 한다. 이러한 아보가드로의 법칙과 이상기체의 상태방정식(PV=nRT)을 실제로 활용하여 에탄올과 부탄의 몰 질량을 알아본다.
[실험 이론]
다음 실험 이론을 조사하시오.
1. 몰질량에 대해 조사하시오.
1-1. 몰 질량
1다스는 달걀이든 코끼리든 상관없이 똑같이 12개이다. 그러나 분명히 달걀 12개의 질량 과 코끼리 12마리의 질량은 같지 않다. 유사하게 1mol은 같은 개수(6.02x102)이지만, 다른 시료 1mol은 서로 다른 질량을 가진다.
예를 들어 12C 1 mol, 24Mg 1 mo l을 비교해 보자. 12C는 12 u의 질량을 가지지만, 24Mg 원자는 두 배 무거운 24u를 가진다.( 유효숫자도 자리를 취할 경우). 1 mol은 항상 같은 개수의 입자를 가지므로, 24Mg 1 mol은 12C 1 mol보다 두 배 더 무겁다. 12C 원자 1 mol은 12 g(정의에 따라) 의 질량을 갖기 때문에 24Mg 원자 1 mol은 24g의 질량을 가져야 한다. 이와 같은 예는 원자 1개의 질량과 이 원자의 Avogadro 수(1mol)의 질량의 관계를 보여준다. 원자질량단위에서 원소 의원 차량은 원소 1m o l을 그램 단위로 나타낸 질량과 수적 이로 같다.
예를 들면 CI 원자 1개는 35.5u 의원 차량을 갖는다. -> CI 원자 1mol은 35.5g의 질량을 갖는다.
Au원자1개는197u의원자량을갖는다. ->Au원자1mol은197g의질량을갖는다.
다른 물질에 대해서도 동일한 수적 관계가 화학 식량과 물질 1 mo 의 질량 사이에 존재 한다.
H2O 분자 1개의 화학 식량은 18.0u이다.- > H20 분자 1 mo의 질량은 18.0g이다.
NaCl의 화학식량은 58.5 u이다. - > NaCl 1 mol의 질량은 58.5g이다.
어떤 물질 1mol의 그램 질량 ( 즉 몰 당 g ) 을 그 물질의 몰 질량 (molar mass ) 이라고 한다. 어떤 물질이든지 그물질의 몰 질량(g 단위로 표시) 은 언제나 그물질의 화학 식량(u 단위로 표시)과 동일 한 수치 이다. 예를 들어 NaCl의 화학 식량은 58.5u, 이고, 몰 질량은 58.5g mol이다.
출처 브라운 일반화학 15판 p105
1-2. 몰질량 (위키백과)
원소의 경우 원자 질량에 원자 질량 단위 대신 몰 질량 단위 g/mol를 붙이면 몰 질량이 된다.
원소의 몰 질량
M(H) = 1.00794(7) × 1 g/mol = 1.00794(7) g/mol
M(S) = 32.065(5) × 1 g/mol = 32.065(5) g/mol
M(Cl) = 35.453(2) × 1 g/mol = 35.453(2) g/mol
M(Fe) = 55.845(2) × 1 g/mol = 55.845(2) g/mol
M(H2) = 2 × 1.00794(7) × 1 g/mol = 2.01588(14) g/mol
M(S8) = 8 × 32.065(5) × 1 g/mol = 256.52(4) g/mol
M(Cl2) = 2 × 35.453(2) × 1 g/mol = 70.906(4) g/mol
화합물의 몰 질량
M(NaCl) = [22.989 769 28(2) + 35.453(2)] × 1 g/mol = 58.443(2) g/mol
M(C12H22O11) = ([12 × 12.0107(8)] + [22 × 1.007 94(7)] + [11 × 15.9994(3)]) × 1 g/mol = 342.297(14) g/mol
출처: 위키백과 검색어 : 몰질량
몰 질량 - 위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. -->
ko.wikipedia.org
2. 기체와 이상기체에 대해 조사하시오.
2-1. 이상기체
각 법칙은 비례 관계식으로 표현할 수 있다. '비레한다'라는 뜻의 부호를 사용하면 다음과 같이 나타낼 수 있다.
Boyle 법칙: V 비례 1/P (n.T일정)
Charles 법칙: V 비례 T (n, P 일정)
Avogadro 법칙: V 비례 n (P, T 일정)

이 관계식들을 조합하면 일반적인 기체 법칙을 만들 수 있다.
V 비례 nT/P
비례 상수를 R이라고 하면, 등식은 다음과 같다.
V=R(nT/P)
이 식을 재정리하면, 다음과 같이 이상 기체식(ideal gas equation) 또는 이상 기체 법칙(ideal gas law)이라고 하는 식이 얻어진다.
PV = nRT

이상 기체(ideal gas)란 압력, 부피, 온도 사이의 관계식이 이상 기체식으로 완벽하게 기술되는 가 상의 기체를 말한다.
이상 기체식을 유도할 때, 두 가지 가정이 존재한다.
이상 기체 분자들은 서로 상호 작용하지 않으며,
분자들의 전체 부피는 기체가 차지하는 부피에 비해 훨씬 작다.
이런 이유로 용기 속에서 분자들이 차지하는 공간은 없다고 생각한다. 많은 경우 이런 가정으로 인해 도입되는 작은 오차는 허용될 수 있다. 좀 더 정확한 계산이 필요하다면, 분자 간에 존재하 는 인력과 분자의 크기에 대해 알고 있으면 이 가정을 보정할 수 있다.
이상 기체식에서 R을 기체 상수(g25 constant)라고 한다. R의 값과 단위는 사용된 P. V. m, T의 단 위에 의존한다. 이상 기체식에서 T의 값은 항상 절대 온도(섭씨 대신에 켈빈으로)여야 한다. 기체 의 양"은 보통 몰수로 나타낸다. 압력의 단위는 보통 atm이나 Pa를 사용하며, 부피는 리터(L)로 나타낸다. 표 10.2는 여러 가지 단위로 표현된 R의 수치를 나타내고 있다. 이상 기체식을 사용할 때는 문제에서 주어진 P. V. n. T의 단위들과 일치하도록 R의 형태를 선택해야한다.
101.325 kPa, 0.00 C(273.15 K)에서 1.000 md의 이상 기체를 생각해 보자. 이상 기체식에 따라 기체의 부피는 다음과 같다.
V=nRT/P
=(1.000 mol) (8.314 m° Pa/mol K) (273.15 K) / 101.325 X 103 Pa
= 22.41L

0 도C, 101.325 KPa 상태를 표준 온도 압력(standard temperature and pressure, STP)이라고 한다.
SIP에서 1 ma의 이상 기체가 차지하는 부피는 22.41 L인데, 이것은 SIP에서 이상 기체의 몰부피 (molar volure)로 알려져 있다.
이상 기체식은 다양한 상황에 존재하는 대부분의 기체의 성질을 잘 설명해 준다. 그러나 이상 기체식은 실제 기체를 정확하게 설명하지는 못한다. 따라서 P, n, T가 일정한 값을 가질 때 측정 된 부피는 PV=nRT로부터 계산된 부피와 다를 수 있다(그림 10.10). 실제 기체들은 항상 이상적인 거동을 하지는 않지만, 이상적 거동과 비교하여 그 차이가 매우 작다.따라서 가장 정교한 연구를 제외한 모든 연구에서 그 차이를 무시할 수 있다.
출처 : 브라운 일반화학 p 455
2-2. 실제 기체
실제 기체(Real gas)는 이상 기체와 다르게 상전이가 있고, 분자간의 인력과 부피가 있는 말 그대로 실제로 존재하는 기체다.
실제 기체는 분자가 공간을 차지하고 상호작용을 하는 비이상 기체이다. 결과적으로 그들은 이상 기체 법칙을 준수하지 않는다. 실제 기체의 거동을 이해하려면 다음 사항을 고려해야 한다.
압축성 효과
가변 비열 용량
반 데르 발스 힘
비평형 열역학적 효과
가변 조성을 갖는 분자 해리 및 기본 반응 문제
브라운 일반화학 15판 내용
실제 기체가 이상적 거동에서 벗어나는 정도는, 이상 기체식을 재정리하여 표현한 1 값으로 알 수 있다.
pV/RT=n
이상 기체 1 mol의 PV/RT 값은 모든 압력에서 1이다. 그림 10.19에 PV/RT를 몇 가지 실제 기체의 1 mol에 대한 P의 함수로 제시하였다. 기체의 종류에 따라 다르긴 하지만, 대개 높은 압력(1.013 MPa 이상)에서 이상적 거동(PV/RT=1)으로부터 많이 벗어난다. 다시 말해. 실제 기체는 높은 압 력에서 이상적으로 거동하지 않는다. 그러나 낮은 압력(1.013 MP3 미만)에서는 이상적 거동에서 많이 벗어나지 않는다. 따라서 큰 오차 없이 이상 기체식을 사용할 수 있다.
실제 기체가 이상적 거동으로부터 벗어나는 것은 온도에도 의존한다. 즉 온도가 상승할수록 실 제 기체의 거동은 이상 기체와 유사해진다 일반적으로 이상적 거동으로부터 벗어남 은 온도가 낮을수록 증가하고, 특히 액화하는 온도에 가까율수록 오차가 크다.
기체 분자 운동론의 기본적 가정에서 실제 기체가 이상적 거동에서 벗어나는 이유를 살펴볼 수 있다. 이상 기체 분자는 공간을 차지하지 않고 분자 사이에 인력이 없다고 가정한다. 그러나 실 제 분자는 일정한 부피를 가지고 있으며, 서로 인력이 작용한다. 그림 10.21에서처럼 실제 기체의 경우 분자들이 이동할 수 있는 빈 공간은 용기 부피보다 약간 더 작다. 비교적 낮은 압력에서 기 체 분자의 부피는 용기 부피에 비해 무시할 정도이다. 따라서 분자들이 이용할 수 있는 자유 부피 는 본질적으로 모든 용기의 부피이다. 높은 압력에서 기체 분자들이 차지하고 있는 부피는 용기의부피에 비해 더 이상 무시할 수 없을 정도로 커진다. 실제로 기체 분자가 자유롭게 이동할 수 있는 빈 공간은 용기의 부피보다 더 작을 수밖에 없다. 따라서 이러한 조건에서 기체의 부피는 이상 기체 방정식에 의해 예상할 수 있는 값보다 약간 커 진다.
그 외에 기체 분자들이 고압 조건에서와 같이 가까이 모여 있으면, 분자 사이에 인력이 작용한다. 이러한 인력 때문에 용기 벽과 분자의 충돌은 감소하게 된다. 만 약 기체의 움직임을 순간 정지시킨다면, 그림 10.22와 비슷한 그림을 얻을 수 있을 것이다. 벽과 부딪치려는 분자는 이웃한 분자의 인력을 동시에 느낀다. 이와 같은 인력은 분자들이 벽과 부딪치는 힘을 약화시키게 되므로, 압력은 이상 기체의 경 우보다 더 작아지게 된다. 따라서 그림 10.19와 10.20에서와 같이 PV/RT를 이상적 인 값 아래로 감소하게 만든다. 그러나 압력이 충분히 높으면, 앞에서 설명한 부피 효과가 지배적이 되고, 따라서 PV/RT는 이상적인 값 이상으로 증가한다.
온도는 낮은 압력에서 기체 분자 사이의 인력이 얼마나 효과적인가를 결정한다.
그림 10.20과 같이 압력이 40 MP 미만이면, 실제 기체는 냉각할수록 이상적 거동에서 벗어난다.
기체를 냉각하면 평균 운동 에너지는 감소하는 반면에, 분자 사이의 인력은 일정하게 유지된다.
따라서 기체를 냉각하면 기체 분자의 인력으로부터 벗어나는 데 필요한 에너지가 부족하게 된다.
결과적으로 기체 분자들이 서로 충돌하기보다는 확률적으로 가까이 붙어 있는 경우가 더 많아지게 된다.
그림 10.20은 온도가 200 K에서 1000 K로 증가할 때 PV/ RT 값이 점점 더 이상적 거동에 가까워 짐을 보인다. 앞에서 언급한 것처럼, 고온에서 실제 기체의 거동은 주로 분자들의 일정한 부피 효 과로부터 생긴다.
출처 위키백과 검색어 '실제 기체'
브라운 일반화학 15판 p 475 ~ 477
3. 실체기체의 상태 방적식에 대해 조사하시오.
고압에서는 실제기체와 이상기체의 거동이 큰 차이를 보인다.
실제 기체는 이상 기체와 비교하여 분자간 인력이 작용하므로 낮은 압력을 가지며, 아주 작게나 마 부피가 크다. van der Waals는 기체 분자들이 차지한 일정한 부피와 기체 분자간 인력에 대한 보정을 하면 이상 기체식을 이용하여 실제 기체의 거동을 표현할 수 있음을 인식했다. 기체 분자 사이의 인력을 보정하는 a와 기체 분자의 부피를 보정하는 6의 두 가지 보정 상수를 도입하여, 다 음과 같은 van der Waals 식(ran der Waals equation)을 수립하였다.
(P + n^2*a/V^2)(V- nb) = nRT
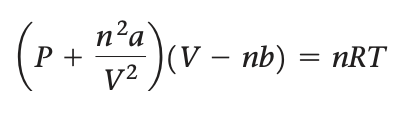
n^2a/V^2은 인력을 나타내는 항이다. 분자 사이의 인력으로 인해 압력이 감소하므로, n^2a/V^2을 더하 여 분자 사이의 인력에 의한 압력 감소를 보정한다분자간 인력은 단위 부피당 분자 수의 제곱((n/V)^2)에 비레하므로 n^2a/V^2은 분자 한 쌍 사이의 인력을 나타낸다.
nb는 실제 기체 분자가 차지한 일정량의 부피를 표현한다. 실제 기체는 nb만큼의 부 피를 차지하고 있으므로 이상 기체가 움직일 수 있는 자유 부피에 대해 nb만큼 감소한 자유 부피 를 갖는다. a와 b는 van der Waals 상수(van der Waals constanl)라고 하는데, 실험적으로 측정되 는 양의 값이며 기체에 따라 각기 다르다. 표 10.3에서 0와 b 값은 일반적으로 분자량이 증가함에따라. 그리고 분자 복잡성이 증가함에 따라 커진다. 그 이유는 분자량과 크기가 클수록 부피는 더 커지고, 분자간 인력도 더 크기 때문이다.
출처: 브라운 일반화학 15판 p 477 ~ 478
4. 위 시약들의 물리적, 화학적 특성과 그 위험성에 대해 조사하시오. (몰질량, 녹는점, 끓는점 포함)
[기구와 시약]
- 시약
에탄올, butane
- 기구
둥근바닥 플라스크, 비커, 메스실린터, 핀셋, 바늘, 온도계, 파라필름, 분젠버너, 스탠드, 클램프, 석면판, 저울, 알루미늄박, 가는 관
4-1. 에탄올
에탄올의 시성식은 CH3−CH2−OH 또는 C2H5OH (하이드록실기에 연결된 에틸기)로도 쓸 수 있으며, 종종 EtOH로 약칭되기도 한다. 에탄올은 약간 특유한 냄새가 나는 휘발성, 인화성, 무색 액체이다. 에탄올은 향정신성 약물 및 기분전환용 약물이며 술(알코올 음료)에 들어 있는 활성 성분이다.
에탄올은 당을 효모로 발효시켜 자연적으로 생산하거나 에틸렌 수화와 같은 석유화학 공정을 통해 생산한다. 에탄올은 살균제 및 소독제와 같은 의료용으로도 사용된다. 에탄올은 화학 용매 및 유기 화합물의 합성에도 사용된다. 에탄올은 연료로도 사용된다.
물리적 특성
화학식: C2H5OH
분자량: 46.07 g/mol
외관: 무색 액체
냄새: 특유한 알코올 냄새
녹는점: -114.1°C
끓는점: 78.37°C
밀도: 0.789 g/cm³
용해도: 물과 잘 혼합 (무한히 혼합 가능)
에탄올은 산소와 반응하여 화염을 일으킬 수 있습니다. 이는 에탄올의 불안정성을 의미합니다.
산화 작용으로 인해 에탄올은 알데히드, 산성 산소 및 다른 산화제와 반응할 수 있습니다.
에탄올은 산과 반응하여 에틸 아세테이트 등의 에스터를 생성할 수 있습니다.
위험성
높은 농도의 에탄올은 인체에 유독할 수 있습니다. 경구 투여 또는 흡입으로 인한 중추 신경계 저하, 간 손상 및 기타 건강 문제를 초래할 수 있습니다.에탄올은 화염을 일으킬 수 있으며, 높은 농도의 증기는 폭발 위험이 있습니다. 따라서 적절한 환기 없이 사용하면 화재의 원인이 될 수 있습니다.
에탄올은 눈과 피부에 자극을 줄 수 있으며, 장기간 노출되면 건조하고 각질이 쌓일 수 있습니다.
산화 작용을 통해 에탄올은 유독한 산소 화합물로 변할 수 있습니다.
에탄올은 일상 생활에서 많이 사용되는 화합물 중 하나이지만 위험성이 있을 수 있으므로 적절한 안전 조치를 취하는 것이 중요합니다. 에탄올을 다룰 때는 적절한 환기를 유지하고 화염과 불꽃으로부터 멀리하며, 피부와 눈에 대한 보호장비를 사용해야 합니다. 또한, 에탄올을 보관 및 처분할 때는 환경 오염을 최소화하기 위해 관련 규정을 준수해야 합니다.
출처: 위키백과 검색어 '에탄올', MSDS 검색어 '에탄올'
4-2. butane (뷰테인)
뷰테인(영어: Butane) 또는 부탄(독일어: Butan)은 알칸족 탄화 수소이다.화학식은 C4H10이고, 노르말-부탄(n-butane) 외에 아이소뷰테인(Isobutane) 이성질체가 있다.
뷰테인은 상온에서 액체로 쉽게 변하는 무색 및 무향의 기체이며, 가연성이기 때문에 연료로 많이 쓰인다. 뷰테인 가스도 뷰테인을 사용해 만들었는데, 많은 나라에서 19세, 20세, 21세 미만에게 뷰테인 가스를 팔지 못하게 하고 있다. (대한민국의 경우, 만 19세 미만은 뷰테인 가스를 사지 못한다.) 뷰테인 가스에서 냄새가 나는 이유는 가스가 용기에서 새어 나올 경우 사람이 인지할 수 있도록 첨가한 부취제(착취제, 불황성 황화합물)의 냄새이다.
산소가 많은 환경에서 뷰테인을 태우면 이산화 탄소와 수증기가 발생하고, 산소가 많이 없는 경우에는 탄소 또는 일산화 탄소가 추가로 발생할 수도 있다.
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
2 CH3CH2CH2CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O
뷰테인 기체는 캔으로 포장되어 요리 및 야외용 연료로 판매된다. 프로페인을 포함한 다른 탄화 수소 물질과 섞은 것을 액화 석유 가스라고 부른다.
아이소뷰테인은 할로메테인을 대체하는 냉각제로도 쓰이고 있다. 일반적인 전자제품에 쓰이는 뷰테인의 양은 실내에 있는 공기의 양에 비해 현저히 적기 때문에 둘은 반응도 할 수 없다고 봐야 하며, 따라서 뷰테인이 가연성 물질임에도 불구하고 전자 제품에 들어간 뷰테인에 의한 화재는 거의 불가능하다.
물리적 특성
화학식: C4H10분자량: 58.12 g/mol
외관: 무색 기체
냄새: 특유한 기체 냄새
녹는점: -155.2°C
끓는점: -0.5°C
밀도: 2.51 g/cm³ (0°C, 액체 상태에서)
증기압: 470 mmHg (25°C)
화학적 특성
뷰테인은 탄소와 수소로 이루어진 알칸으로, 메테인(CH4)과 유사한 구조를 갖습니다.뷰테인은 비극성 기체로, 물과는 혼합이 불가능하지만 다른 유기 용매와는 잘 혼합될 수 있습니다.
뷰테인은 불연성이며, 공기와 반응하지 않습니다.
위험성
뷰테인의 흡입은 졸림, 질식, 부정맥 또는 동상의 원인이 될 수 있으며 빠른 시간 이내에 사망으로 이어지기도 한다. 사람의 목에 뷰테인을 직접적으로 뿌릴 경우에는 뷰테인 액체의 부피가 증가하여 성문경련을 일으키기도 한다.뷰테인은 비인화성이기 때문에 화염이나 불꽃에 접촉하여도 자체적으로 불이 붙지는 않습니다. 그러나 뷰테인 가스와 공기 또는 산소가 혼합되면 폭발 위험이 있습니다.
뷰테인은 과도한 농도로 인한 유독성이 있습니다. 호흡과 피부 접촉에 대한 위험이 있으며, 증상은 두통, 어지러움, 메스꺼움 등이 포함될 수 있습니다.
뷰테인은 높은 압력이나 온도 조건에서 출현할 수 있는 폭발 위험을 가지므로, 적절한 안전 절차를 준수해야 합니다.
뷰테인은 환경에 대한 위험성이 낮지만, 무단으로 배출하거나 적절한 방법으로 처리하지 않을 경우 환경 오염의 원인이 될 수 있습니다.
뷰테인은 일반적으로 가연성 가스와 연료, 스프레이 제품, 충전기 등 다양한 산업 및 소비자용 제품에서 사용됩니다. 하지만 뷰테인을 다룰 때는 적절한 안전 절차를 따라야 하며, 공기 중에서의 높은 농도나 폭발 위험에 대비해야 합니다.
출처: 위키백과 검색어 '뷰테인' MSDS 검색어 '부탄'
에탄올 - 위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. 에탄올 이름 발음 우선명 (PIN) 별칭 absolute alcohol,alcohol,cologne spirit,drinking alcohol,ethylic alcohol,EtOH,ethyl alcohol,ethyl hydrate,ethyl hydroxide,ethylol,grain alcohol,hydroxyethane,methyl
ko.wikipedia.org
뷰테인 - 위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. 뷰테인(영어: Butane) 또는 부탄(독일어: Butan)은 알칸족 탄화 수소이다. 화학식은 C4H10이고, 노르말-부탄(n-butane) 외에 아이소뷰테인(Isobutane) 이성질체가 있다. 뷰
ko.wikipedia.org
5. [실험 방법] 실험 과정은 다음과 같다.
부탄가스의 몰 질량 측정에서 순수한 부탄 가스의 압력(atm)을 구하시오.
이때 대기압은 1atm이며, 20℃에서 물의 증기압은 0.0231 atm이다.
◈ 에탄올의 몰 질량 측정
① 500 mL 비커에 물을 350 mL정도 채우고 끓을 때까지 가열한다.
② 가열하는 동안 깨끗하게 씻어 오븐에 말린 100 mL 둥근 플라스크, 알루미늄박, 파라필름의 총 무게를 저울을 사용해 소수점 셋째 자리까지 정확하게 읽는다.
③ 플라스크에 약 3 mL의 에탄올을 넣고 알루미늄박으로 막은 뒤 파라필름을 사용하여 옆 부분을 고정시키고, 스탠드에 세팅한다.
④ 물이 끓으면 물의 온도를 재고, 플라스크를 비커의 바닥에 닿지 않을 정도로 물 속에 깊이 넣는다.
⑤ 플라스크 속의 액체가 모두 기화할 때까지 기다린다. (약 5~6분)
⑥ 플라스크의 액체가 모두 기화하면, 플라스크를 끓는 물에서 꺼내 실온까지 식힌다.
⑦ 플라스크 바깥에 묻은 물은 수건을 사용해서 완전히 닦아낸다.
⑧ 실온까지 식힌 플라스크와 알루미늄박 뚜껑(파라필름 포함)의 질량을 다시 측정한다.
⑨ 플라스크를 깨끗하게 씻은 후에 증류수를 가득 채우고, 눈금 실린더에 옮겨 증류수의 부피를 읽는다.
⑩ 위 실험을 반복한다. (총 2회)
⑪ 몰 질량을 계산한다.
◈ 부탄가스의 몰 질량 측정
① 1000 mL 비커에 증류수를 700 mL 가량 채운다. (이 때 물 온도를 측정한다.)
② 100 mL 메스실린더에 증류수를 가득 채운다. (찰랑거릴 정도까지)
③ 메스실린더에 공기가 들어가지 않도록 입구를 파라필름으로 막은 채 뒤집어서 비커에 담그고, 핀셋을 이용하여 파라필름을 제거한다.
④ 준비된 라이터의 무게를 소수점 셋째 자리까지 정확히 읽어서 기록한다.
⑤ 가는 관을 준비된 일회용 라이터의 가스 나오는 부위에 결합시킨 후, 관의 반대편을 핀셋을 이용해 뒤집어져 있는 메스실린더의 안쪽에 위치시킨다.
⑥ 비커의 수면과 메스실린더 안 수면의 높이가 일치할 때까지 라이터 가스를 포집한 뒤 가스가 채워진 만큼의 부피를 읽는다.
⑦ 실험 후, 라이터의 무게를 소수점 셋째 자리까지 정확히 읽어서 기록한다.
⑧ 위 실험을 반복한다. (총2회)
⑨ 몰 질량을 계산한다.
5. A 0.9769

sol)
= 대기압 -물의 증기압
= 1atm-0.0231 atm
6. 출처
https://www.aladin.co.kr/shop/wproduct.aspx?ItemId=308141486
Brown 일반화학 (일반화학교재연구회)
Brown 일반화학 (일반화학교재연구회)
www.aladin.co.kr
https://msds.kosha.or.kr/MSDSInfo/kcic/msdssearchMsds.do
안전보건공단 화학물질정보 | MSDS검색
본문내용 산업안전보건법 제110조 및 111조에 의거 유통되는 화학물질 및 화학물질을 함유한 제제의 물질안전보건자료(MSDS)는 해당 물질을 양도하거나 제공(제조·수입·판매자(도·소매업자))하
msds.kosha.or.kr
'일반화학실험 > 화학및 실험1(실험)' 카테고리의 다른 글
| [화학및 실험1] 10주차 예비보고서, 기체 상수의 결정 (0) | 2023.06.22 |
|---|---|
| [화학및 실험1] 9주차 결과보고서, 에탄올과 부탄가스의 몰질량 측정 (0) | 2023.06.21 |
| [화학및 실험1] 8주차 결과보고서, 미지시료에 포함된 음이온의 정성분석 (0) | 2023.06.21 |
| [화학및 실험1] 8주차 예비보고서, 미지시료에 포함된 음이온의 정성분석 (0) | 2023.06.20 |
| [화학및 실험1] 7주차 결과보고서, 미지시료에 포함된 양이온의 정성분석 (1) | 2023.06.19 |



