1. 실험 목적
아보가드로의 법칙에 의하면 일정한 온도와 압력에서 같은 부피의 기체에는 기체의 종류와 무관하게 같은 수의 분자가 들어 있다고 한다. 이러한 아보가드로의 법칙과 이상기체의 상태방정식(PV=nRT)을 실 제로 활용하여 에탄올과 부탄의 몰 질량을 알아본다.
2. 실험 이론
원자나 분자는 매우 작은 입자이기 때문에 질량을 직접 측정하는 것은 매우 어렵다. 그래서 원자나 분 자의 질량을 나타내기 위해서 1몰에 해당하는 분자의 질량을 탄소원자 1몰의 질량과 비교하여 결정한다. 분자의 몰 질량을 측정하는 방법은 여러 가지가 있다. 그 중에서도 가장 간단하게 몰 질량을 측정하는 방 법은 기체의 상태 방정식을 이용하는 것이다. 대부분의 기체는 상온, 상압에서 이상기체 상태 방정식을 만족하기 때문에 기체의 부피, 온도, 압력과 함께 용기를 가득 채우는데 필요한 질량 m을 측정하면 이상 기체 상태 방정식으로부터 몰 질량 M을 구할 수 있다.
<조사할 내용>
1) 몰 질량의 개념
2) 실제기체와 이상기체의 차이
3) 실제기체 상태 방정식에 대한 조사
(9주차 예비보고서에서 작성)
https://devlawyer.tistory.com/26
[화학및 실험1] 9주차 예비보고서, 에탄올과 부탄가스의 몰질량 측정
[실험 제목] 에탄올과 부탄가스의 몰 질량 측정 [실험 목적] 아보가드로의 법칙에 의하면 일정한 온도와 압력에서 같은 부피의 기체는 기체의 종류와 무관하게 같은 수의 분자가 들어 있다고 한
devlawyer.tistory.com
3. 실험방법
<주의사항>
본 실험은 버너를 이용할 뿐만 아니라 연소성 부탄가스를 포집하는 실험이므로 부주의하게 가스를 포집한 후, 불꽃을 일으킨다거나 버너를 사용하는 일이 없도록 각별히 주의하도록 하자.
3-1. 에탄올의 몰질량 측정

1 500 mL 비커에 물을 350 mL정도 채우고 끓을 때까지 가열한다.
2 가열하는 동안 깨끗하게 씻어 오븐에 말린 100 mL 둥근 플라스크, 알루미늄박, 파라필름의 총 무게 를 저울을 사용해 소수점 셋째 자리까지 정확하게 읽는다.
플라스크의 바닥이 둥글기 때문에 안정적으로 실험하기 위해 빈 비커에 넣고 무게를 측정한다.
3 플라스크에 약 3mL의 에탄올을 넣고 알루미늄박으로 막은 뒤 파라필름을 사용하여 옆 부분을 고정 시키고, 스탠드에 세팅한다. (그림 참조)
4 물이 끓으면 물의 온도를 재고, 플라스크를 비커의 바닥에 닿지 않을 정도로 물 속에 깊이 넣는다.
이 때, 기체가 새어 나올 구멍을 알루미늄박에 바늘을 이용해 최대한 작게 뚫는다.
※ 둥근 플라스크를 물 속에 깊이 담그는 것은 열전달을 균일하게 하여 플라스크 내부에 존재하던 공기를 제거하고 완전히 기화한 에탄올로 채우기 위함이다.
5 플라스크 속의 액체가 모두 기화할 때까지 기다린다 (약 5~6분). 뚜껑에 뚫린 구멍을 옆에서 자세 히 관찰하면 빛의 산란 때문에 기체가 새어 나오는 것을 관찰할 수 있다.
6 플라스크의 액체가 모두 기화하면, 플라스크를 끓는 물에서 꺼내 실온까지 식힌다 (이때, 플라스크 는 매우 뜨거우므로 손으로 직접 만지지 않도록 주의한다).
7 플라스크 바깥에 묻은 물은 수건을 사용해서 완전히 닦아낸다.
8 실온까지 식힌 플라스크와 알루미늄박 뚜껑(파라필름 포함)의 질량을 다시 측정한다.
9 플라스크를 깨끗하게 씻은 후에 증류수를 가득 채우고, 눈금 실린더에 옮겨 증류수의 부피를 읽는다. (부피가 100 mL가 넘으므로 스포이드를 이용해 정확한 부피를 얻을 수 있도록 한다.)
10 위 실험을 반복한다 (총 2회).
11 몰 질량을 계산한다.
3-2. 부탄가스의 몰질량 측정

1 1000 mL 비커에 증류수를 700 mL 가량 채운다. (이 때 물 온도를 측정한다.)
2 100 mL 메스실린더에 증류수를 가득 채운다. (찰랑거릴 정도까지)
3 메스실린더에 공기가 들어가지 않도록 입구를 파라필름으로 막은 채 뒤집어서 비커에 담그고, 핀셋을 이용하여 파라필름을 제거한다.
4 준비된 라이터의 무게를 소수점 셋째 자리까지 정확히 읽어서 기록한다.
5 가는 관을 준비된 일회용 라이터의 가스 나오는 부위에 결합시킨 후, 관의 반대편을 핀셋을 이용해 뒤집어져 있는 메스실린더의 안쪽에 위치시킨다.
6 비커의 수면과 메스실린더 안 수면의 높이가 일치할 때까지 라이터 가스를 포집한 뒤 가스가 채워진 만큼의 부피를 읽는다.
7 실험 후, 라이터의 무게를 소수점 셋째 자리까지 정확히 읽어서 기록한다.
8 위 실험을 반복한다 (총2회).
9 몰 질량을 계산한다.
4. 기구와 시약
둥근바닥 플라스크, 비커(500mL, 1000mL), 메스실린더(10mL, 100mL), 핀셋, 바늘, 온도계, 파라필름, 분젠버너, 스탠드, 클램프, 석면판, 저울, 알루미늄박, 에탄올, 가스라이터, 가는 관
5. 실험 과정
5-1. 에탄올 몰질량 측정






둥근바닥플라스크는 134ml 이다.
5-2. 부탄가스 몰질량 측정



가는관 메스실린더 밑에 넣는거 개어렵ㅎㅎ
(라이터가스 빼는 거라 오래걸리진 않음)
6. 실험 결과

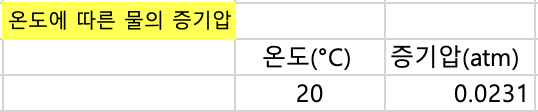

7. 관찰과 결과분석
7-1. 에탄올의 몰 질량을 구하는 풀이과정을 설명하시오.
PV = wRT/M 이고 이때 몰질량이 M이므로 한 쪽으로 정리하면
M = wRT/PV (M: 몰질량(g/mol), w:질량(g), R: 기체상수(atm*L/mol*K), T: 온도(K), P: 압력(atm), V: 부피(L)
에다가 위에서 구한 각각의 값 대입하면
1회
w = 0.215 g
R = 0.08206 atm*L/mol*K
T = 97.5 + 273.15 K
P = 1 atm
V = 0.143L
그러므로
M1= (0.215 x 0.08206 x 370.65) / (1 x 0.143) = 45.730
2회
w = 0.292g
R = 0.08206 atm*L/mol*K
T = 372.15K
P = 1atm
V = 0.143L
그러므로
M2 = (0.292 x 0.08206 x 372.15) / (1 x 0.143) = 62.359
평균 몰질량은 (M1 + M2)/2 = 54.045g/mol
7-2. 뷰테인(부탄)의 몰 질량을 구하는 풀이과정을 설명하시오.
PV = wRT/M 이고 이때 몰질량이 M이므로 한 쪽으로 정리하면
M = wRT/PV (M: 몰질량(g/mol), w:질량(g), R: 기체상수(atm*L/mol*K), T: 온도(K), P: 압력(atm), V: 부피(L)
에다가 위에서 구한 각각의 값 대입하면
1회
w = 0.201 g
R = 0.08206 atm*L/mol*K
T = 293.15 K
P = 0.9769 atm
V = 0.076L
그러므로
M1= (0.201 x 0.08206 x 293.15) / (0.9769 x 0.076) = 65.126
2회
w = 0.215g
R = 0.08206 atm*L/mol*K
T = 293.15K
P = 0.9769atm
V = 0.078L
그러므로
M2 = (0.215 x 0.08206 x 293.15) / (0.9769 x 0.078) = 67.876
평균 몰질량은 (M1 + M2)/2 = 66.501g/mol
7-3. 에탄올의 몰 질량 측정 실험에서 사용한 에탄올의 양이 충분하지 않아 기화한 에탄올이 플라스크를 완전히 채우지 못했다면 어떤 결과가 얻어지겠는가?
이때, 공기의 평균 분자량 28.84g/mol로 에탄올 기체의 분자량(46.08g/mol)보다 작기 때문에 실험 분자량 계산시 섞인기체로 계산하게되면
위에서 보인 M = wRT/PV 식에 으로 계산을 하게되면
정상적으로 실험을 진행 하였을 때 보다 공기가 더 많이 섞이면 섞일 수록 실험값이 더 작은 값을 가지게 될 것이다. 그러므로 에탄올 기체를 잘 채우는 것이 중요하다.
7-4. 에탄올의 몰 질량 측정 실험에서 액체 시료에 기화하지 않는 불순물이 녹아 있다면 실험결과가 어떻게 되겠는가?
에탄올을 전부 기화 시킨후 불순물이 남아 있게 된다면, 플라스크의 내부를 에탄올의 기체 뿐만 이 아니라 불순물이 포함되어 있기 때문에, 에탄올 기체의 부피를 측정하는데 오차가 발생할 것이다.
위 실험에서 무게를 측정할 때 응축된 시료의 무게(g)의 값에 불순물 무게가 추가되었다는 이야기다.
M = wRT/PV에서 w값이 증가 했을 것이므로 불순물의 양 만큼 계산하는 시료의 몰 질량이 증가 하게되었을 것이다.
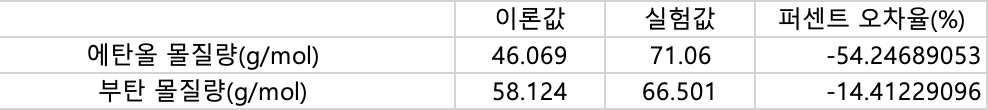
7-5.실험결과로 나온 에탄올과 뷰테인(부탄)의 몰 질량의 평균을 이용하여 오차율를 구하고, 실험값이 이론값과 차이가 나는 이유를 설명해보시오. (오차율 구하는 풀이과정 필수)
에탄올 몰질량(g/mol) 46.069 71.060
부탄 몰질량(g/mol) 58.124 66.501
에탄올실험 퍼센트 오차율(%) = (46.069 - 71.06)*100 / 46.069 = -54.247%
뷰테인실험 퍼센트 오차율 = (58.124 - 66.501)*100 / 58.124 = -14.412%
둘다 실험값이 이론 값에 비해 크게 측정되었다.
위에서 1)은 대체적으로 실험값이 작게나온 요인들이고 2)는 실험값이 크게 나오게 되는 요인이다.
1. 2)을 빌려서 설명하면 실험도중 물기나 각종 불순물 들이 남아 있어서 기화되지 않은 불순물들이 많게 되어서 실험값이 크게 측정되었던것 같다.
2. 4주차때 마그네슘 연소반응 실험때도 관찰하였지만, 우리조 화력(불의 세기)가 약한 것같다. 물이 100도까지 가는 시간도 너무 오래 걸렸고 최종적으로 97.5도 까지밖에 도달하지 못했다. 그만큼 기화되는 에탄올 양 자체도 줄어들 것으로 예상된다.
3. 실험과정중 '기체가 새어 나올 구멍을 알루미늄박에 바늘을 이용해 최대한 작게 뚫는다.' 과정이 있었는데 우리조 가열시간이 다른 조에 비해 상당히 길었다. 긴만큼 공기가 새어나갈 시간에 에탄올도 세어 나갔을 것으로 추정된다.
8. 후기
8-1. 매번 그렇지만 실험전에 설명들을 때는 긴가민가 하는데
실험 하고 나서는 무엇을 얻고자 하는지 확실히 이해가는듯 (경험주의야~)
8-2. 화력이 약해 걱정되었는데 어찌저찌 실험이 됬다.
8-3. 100ml 둥근바닥플라스크 가득채우면 134ml정도 나온다. (이럴꺼면 134ml 플라스크라고 하자)
8-4. 이상기체 상태방정식으로 계산할때 표준상태의 단위를 기억하자
(계산하는거 은근히 재미있음ㅎ)
8-5. 실제기체 방정식으로 계산하는 날이 올까?
'일반화학실험 > 화학및 실험1(실험)' 카테고리의 다른 글
| [화학및 실험1] 10주차 결과보고서, 기체 상수의 결정 (0) | 2023.06.22 |
|---|---|
| [화학및 실험1] 10주차 예비보고서, 기체 상수의 결정 (0) | 2023.06.22 |
| [화학및 실험1] 9주차 예비보고서, 에탄올과 부탄가스의 몰질량 측정 (0) | 2023.06.21 |
| [화학및 실험1] 8주차 결과보고서, 미지시료에 포함된 음이온의 정성분석 (0) | 2023.06.21 |
| [화학및 실험1] 8주차 예비보고서, 미지시료에 포함된 음이온의 정성분석 (0) | 2023.06.20 |



