1. 실험 목적
- 몰 농도 (M), 산·염기의 개념을 이해하고, 식초의 아세트산 (CH3COOH)과 아스피린의 아세틸살리실산 (C6H4(OCOCH3)COOH)을 정량 분석한다.
- 산·염기 적정을 통해 식초 중 아세트산의 함량과 두통약 아스피린 중 아세틸살리실산의 함량을 실험적으로 알아본다.
2. 실험 이론
- 산과 염기의 개념
1) Arrehenius의 정의
2) Brønsted-Lowry의 정의
3) Lewis의 정의 - 산과 염기의 적정
- 산-염기 적정에 사용되는 지시약
- 당량, 당량점, 종말점
(2-5주차 예비보고서에서 작성)
https://devlawyer.tistory.com/61
[화학및 실험2] 5주차 예비보고서, 식초와 아스피린의 정량분석
[실험 제목] 식초와 아스피린의 정량분석 [실험 목적] - 몰농도(M), 산, 염기의 개념을 이해하고, 식초의 아세트산과 아스피린의 아세틸살리실산을 정량 분석한다. - 산, 염기 적정을 통해 식초 중
devlawyer.tistory.com
3. 실험 방법
3-1. 실험A 식초분석
① 100 mL의 1.0 M NaOH 표준용액을 만든다.
몰농도 (M): 용액 1 L 중에 포함되어 있는 물질의 mol 수 (mol/L)
4.000 g의 NaOH (FW = 40 g)을 비커에 넣고 약 80 mL 증류수를 넣은 뒤 녹인다.
100 mL 부피 플라스크에 넣고 증류수를 표시선까지 채워서 흔들어 준다.
② 후드에 비치된 농도가 다른 사과 식초 2가지를 각각 10.0 mL씩 메스실린더로 취하여 250 mL 삼각 플라스크에 넣고 무게를 잰다. (삼각 플라스크의 무게 미리 측정)
③ 40 mL의 증류수를 넣은 다음에 페놀프탈레인 지시약 2-3 방울을 넣는다.
④ 뷰렛에 1.0 M NaOH 표준용액을 넣고 한 번 흘려 내려 씻어준 후 적정을 한다.
(분홍색이 나타나기 시작하면 NaOH 용액을 조금씩 넣어주면서 용액을 잘 저어준다. 분홍색이 30초 이상 지속된 후 없어지면 NaOH 한 방울을 더 넣어주고 종말점으로 간주한다.)
⑤ 반복실험을 한다.
3-2. 실험B 아스피린 분석
① 100 mL의 0.1 M NaOH 표준용액을 만든다.
0.400 g의 NaOH (FW = 40 g)을 100 mL 부피플라스크에 넣고 증류수를 표시선까지 채워서
흔들어 준다.
② 0.100 g의 아스피린을 250 mL 삼각플라스크에 넣는다.
100 mL의 증류수를 넣고 아스피린이 완전히 녹도록 유리막대로 잘 저어준다.
(약 10분 이상 잘 흔들어서 녹인다.)
③ 페놀프탈레인 지시약 2-3 방울을 넣고 0.1 M NaOH 표준용액으로 적정한다.
(분홍색이 30초 이상 지속된 후 없어지면 NaOH 한 방울을 더 넣어주고 종말점으로 간주한다.)
④ 반복실험을 한다.
4. 기구와 시약
기구: 250mL 삼각플라스크 2개, 50 mL 뷰렛 1개, 메스실린더100 mL 1개,
메스실린더10 mL 1개, 스탠드, 클램프, 시약수저, 100 mL 부피플라스크, 유리 막대
시약: 식용식초, 아세트산, 아스피린 (아세틸살리실산), NaOH, 페놀프탈레인 지시약
5. 실험 과정


100 mL 의 0.1 M NaOH 표준용액과 식초용액을 만듭니다.


적정할때 색이 확 갑자기 바뀌기 때문에 미세하게 떨어뜨릴 수 있게 조심해야함!



6. 실험 결과
6-1. 실험 A 위 표의 (4) - (6)빈칸을 채우기 위한 계산식을 서술하시오.
아세트산 분자량 60.052로 계산
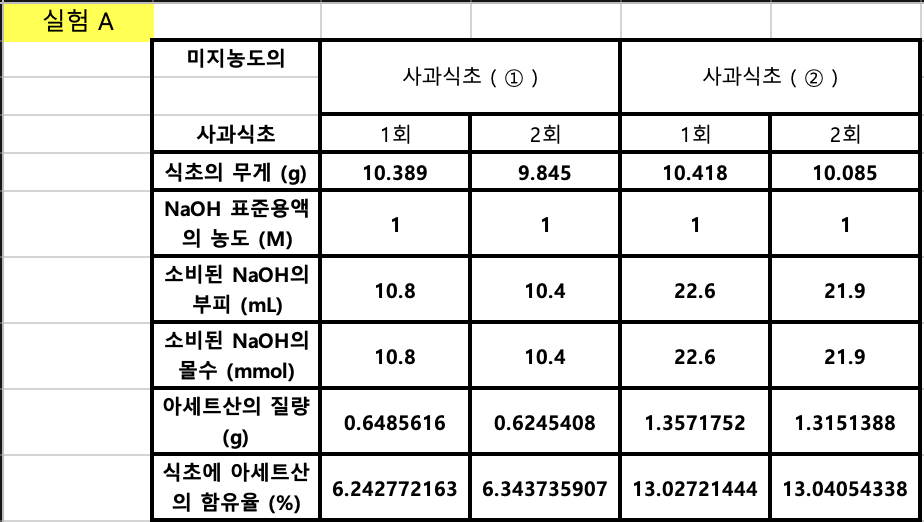
(4)
소비된 NaOH의 몰수 (mmol) = (2) NaOH 표준용액의 농도 (M) x (3)소비된 NaOH의 부피 (mL)
= 1 x 10.8
= 10.8
(5)
아세트산은 수산화나트륨과 1대1로 반응한다
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
그러므로 수산화나트륨의 몰수가 아세트산의 몰수가 된다.
아세트산의 질량 (g)
= 아세트산 분자량(g/mol) x (4)소비된 NaOH의 몰수 (mmol) x 0.001(m^-1)
= 60.052 x 10.8 x 0.001
= 0.6485616
(6)
식초에 아세트산의 함유율 (%)
= ((5) 아세트산의 질량 (g) / (1)식초의 무게 (g)) x 100(%)
= 6.242772163
6-1. 실험 B 위 표의 (4) - (6)빈칸을 채우기 위한 계산식을 서술하시오.
아스피린 분자량 180.158로 계산
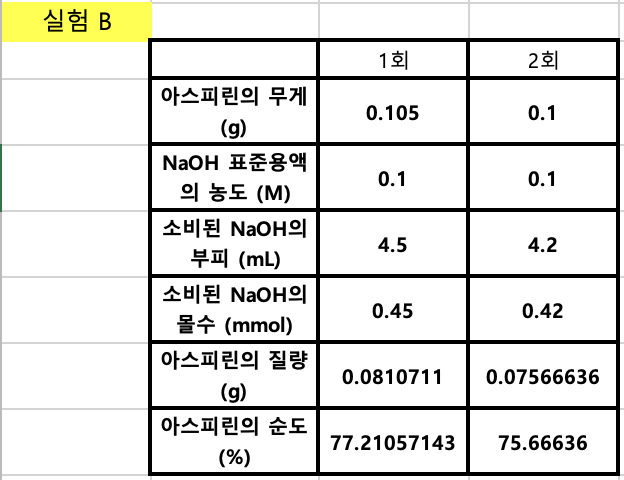
(4)
소비된 NaOH의 몰수 (mmol) = (2) NaOH 표준용액의 농도 (M) x (3)소비된 NaOH의 부피 (mL)
= 0.1 x 4.5
= 0.45
(5)
아스피린의 주성분: 아세틸살리실산
아세틸 살리실산(acetylsalicylic acid, ASA)
1가산이므로, NaOH와 1 : 1 반응한다.
HA + NaOH → NaA + H2O
그러므로 수산화나트륨의 몰수가 아스피린의 몰수라 계산하면된다.
아스피린의 질량 (g)
= 아스피린 분자량(g/mol) x (4)소비된 NaOH의 몰수 (mmol) x 0.001(m^-1)
= 180.158 x 0.45 x 0.001
= 0.0810711
(6)
아스피린의 순도 (%)
= ((5) 아스피린의 질량 (g) / (1)아스피린의 무게 (g)) x 100(%)
= 77.21057143
7. 관찰과 결과분석
7-1.위 실험에서 페놀프탈레인이라는 지시약이 쓰인다. 이 지시약의 역할은 무엇인가?
A.
페놀프탈레인은 약산과 강염기,강산-강염기 적정 실험에 사용된다.
적정예상범위 pH 8.0~10.0에서 무색에서 분홍색으로 변색된다.
적정그래프를 보면 당량점에서 당량점을 막 벗어난 부분이 거의 수직으로 변화하는데 이범위가 변색 범위에 포함된다. 그래서 실험시에 분홍색으로 완전히 변색되서 돌아오지 않으면 용액이 당량점을 지났음과 종말점을 예상할 수 있다.
Phenolphthalein 8.0-10.0 colorless red
페놀프탈레인 지시약은
페놀프탈레인은 벤젠 고리가 3개나 있는 유기물이라서물에 거의 용해되지 않는다.
그래서 에탄올(70%)과 증류수(30%) 혼합 용매에 페놀프탈레인을 용해시켜 조제한다.
7-2.이번 실험에서와 같이 약산을 강염기로 적정할 때 종말점의 pH는 7이 아니다. 그 이유에 대해 서술하여라.
A.
아세트산(약산)과 수산화나트륨(강염기)를
적정 중에는 다음과 같은 중화 반응이 일어난다.
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O
당량점상태에서는 중화반응에 필요한 H+, OH-가 없다
그상태에서는 생성된 염에 의한 가수분해 반응이 일어난다.
CH3COO- + H2O → CH3COOH + OH-
가수분해 반응 결과 OH- 이온이 생성되기 때문에,
중화점(= 당량점)에서의 pH는 7 보다 크다.
7-3. 이번 실험에서 사용한 식초와 아스피린의 아세트산과 아세틸살리실산의 함유량은 다음과 같다. 이때 실험값과 오차율을 구하고 오차의 원인에 대해 서술하시오.
(사과식초① : 6.5 %, 사과식초② : 13.5%, 아스피린 : 90%)
A.
오차율 = |이론값- 실험값| x 100 / 이론값
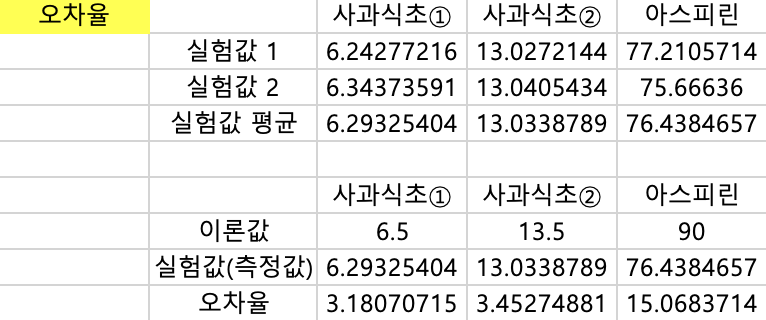
1. 식초마다 아세트산분자들이 고르게 섞이지 않았을 것이다. 그렇다면 실험마다 약간씩 다르게 측정될 것이다.
2. 적정시에 뷰렛의 눈금을 육안으로 확인할 때 소숫점 한자리까지 측정 가능했다. 좀 더 정밀하게 측정해야 오차가 줄어들 것이다.
3. 아스피린 실험시에는 순도가 훨씩 적게 나왔다. 아스피린을 물에 녹일때 완전히 녹이지 못하고 실험에 들어갔다. 그래서 순도가 이론값보다 적게 나왔다. 온도를 높이면서 고체상태없이 다 녹여야 순도가 올바르게 측정 될 것이다.
8. 후기
8-1. 초등학교때도, 중학교때도 했었던 간단한 실험이다. 정량적인 계산만 잘하자
8-2. 위에서도 말했지만 한방울 한방울에 색깔이 급변한다. 정밀한 측정을 위해 뷰렛을 미세하게 잘 조절하면서 적정하자
'일반화학실험 > 화학및 실험2(실험)' 카테고리의 다른 글
| [화학및 실험2] 6주차 결과보고서, 비타 500에 들어있는 비타민 C 정량 분석 (1) | 2024.07.14 |
|---|---|
| [화학및 실험2] 6주차 예비보고서, 비타 500에 들어있는 비타민 C 정량 분석 (2) | 2024.03.18 |
| [화학및 실험2] 5주차 예비보고서, 식초와 아스피린의 정량분석 (1) | 2024.01.18 |
| [화학및 실험2] 4주차 결과보고서, 평형상수의 결정와 Le Chatelier 원리 확인 (1) | 2024.01.16 |
| [화학및 실험2] 4주차 예비보고서, 평형상수의 결정와 Le Chatelier 원리 확인 (0) | 2024.01.16 |



