물질의 '총괄성'인 어는점 내림과 끓는점 오름을 실험적으로 확인하는 실험입니다!
총괄성 정의!
용액 내에 있는 용질 입자의 본질에는 상관없이 용질 입자의 수에만 의존하는 성질
1. 실험 목적
순수한 용매인 사이클로헥세인과 나프탈렌을 용해한 용액의 어는점을 측정 하고 어는점 내림 현상을 이용하여 비휘발성, 비전해질인 나프탈렌의 분자량을 계산한다.
2. 실험 이론
화학에서 분자량을 측정하는 방법에는 여러 가지가있다. 대표적으로 어는점 내림에 의한 분자량측정,끓는점오름에의한분자량측정,이상기체상태방정식( PV = (w/M)nRT )
에 의한 분자량 측정, 빅터 마이어(Victor meyer)법에 의한 분자량 측정이 있다. 용액의 끓는 점 오름, 어는점내림, 그리고 삼투압은 용질 때문에 나타나는 현상들로 용질의 알갱이 수에 만 의존하고 그 종류에 무관하다. 용질은 비휘발성이고 따로 녹아들어가지 않는다는 가정 하에 용액이 얼 때는 순수한 고체 용매만이 분리된다. 이 원리를 이용하여 순수한 사이클로 헥세인의 어는점을 측정하고, 사이클로헥세인에 나프탈렌을 첨가하여 용액의 어는점을 측정 하여 나프탈렌의 분자량을 측정할 수 있다.
<조사할 내용>
1) 몰농도(molarity)와 몰랄농도(molality)에 대해 조사
2) 총괄성의 공통적 특징과 어는점 내림 조사
3) 어는점 내림상수와 어는점 내림을 이용한 몰질량 계산방법 조사
(2-2주차 예비보고서에서 작성)
https://devlawyer.tistory.com/55
[화학및 실험2] 2주차 예비보고서, 사이클로헥세인의 어는점 내림을 이용한 분자량 측정
[실험 목적] 순수한 용매인 사이클로헥세인과 나프탈렌을 용해한 용액의 어는점을 측정하고 어는점 내림 현상을 이용하여 비휘발성, 비전해질인 나프탈렌의 분자량을 계산한다. [실험 이론] 다
devlawyer.tistory.com
3. 실험방법
1) 메스실린더를 이용하여 cyclohexane 20 mL를 시험관에 넣는다.
2) 스티로폼 실린더에 얼음물을 채워 넣고, 염화소듐을 한 스푼 첨가한다. 3) 어는점 내림 측정을 위한 장치를 설치한다.
*온도계는 시험관 벽에 닿지 않도록 솜으로 고정한다.
4) 상온에서 1분 기다리고 cyclohexane의 온도를 측정하여 기록한다.
5) Clamp에 시험관을 고정시키고 얼음에 담근다.
6) 온도계를 좌우상하로 저으며 cyclohexane의 온도를 30초 간격으로 읽어 기록한다. 7) 온도가 일정하다가 강하할 때 까지 측정한다. (약 10분 정도)
8) 시험관을 얼음에서 꺼내 cyclohexane을 상온에서 다시 녹인다.
(cyclohexane이 다시 투명해진다.)
9) Cyclohexane에 Naphthalene 0.16 g을 넣어 위 실험을 반복한다.
10) 위 시험관의 cyclohexane에 Naphthalene 0.16 g을 추가로 넣어 위 실험을 반복한다.
(cyclohexane이 모두 녹은 후 첨가할 것)
11) 어는점 내림을 이용하여 Naphthalene의 분자량을 구한다.
12) 나프탈렌 대신 미지시료 0.16g을 넣고 같은 실험을 반복하여 미지시료가 무엇인지 유추 해 본다.
4. 기구와 시약
Stand, clamp, test tube, 온도계, 유리막대, 스티로폼 박스, 100 mL 메스실린더, 탈지면, 타이머, 얼음, Naphthalene, cyclohexane
5. 실험 과정






6. 실험 결과
각 실험에서의 cyclohexane의 어는점 확인
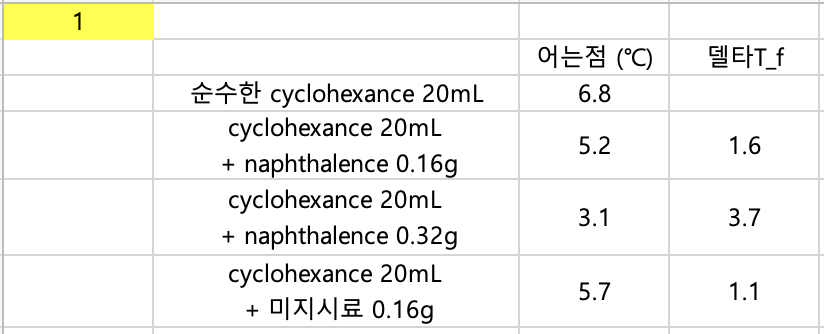
6-1.Cyclohexane 20 mL + Naphthalene 0.16 g 의 실험결과를 토대로 Naphthalene의 분자량을 구하시오.

-
델타 T_f = K_f(용매의 어는점 몰랄 내림 상수) x m(용질의 몰랄농도)
1.6 = 20.0 x { (0.16g / M) / (0.7739g/mL x 20mL x 10^-3)}
M으로 정리하면
1.6 x (0.7739g/mL x 20mL x 10^-3) / 20.0 = 0.16 / M
0.00123824 = 0.16 / M
M = 0.16 / 0.00123824
그러므로 M(나프탈렌 분자량) 은
129.2156609g/mol
6-2. Cyclohexane 20 mL + Naphthalene 0.32 g의 실험 결과를 토대로 Naphthalene의 분자량을 구하시오.

-
델타 T_f = K_f(용매의 어는점 몰랄 내림 상수) x m(용질의 몰랄농도)
3.7 = 20.0 x { (0.16g / M) / (0.7739g/mL x 20mL x 10^-3)}
M으로 정리하면
3.7 x (0.7739g/mL x 20mL x 10^-3) / 20.0 = 0.16 / M
0.00286343 = 0.16 / M
M = 0.16 / 0.00286343
그러므로 M(나프탈렌 분자량) 은
111.7540851g/mol
6-3. Cyclohexane 20 mL + 미지시료 0.16 g의 실험 결과를 토대로 미지시료의 분자량을 구하시오.

-
델타 T_f = K_f(용매의 어는점 몰랄 내림 상수) x m(용질의 몰랄농도)
1.1 = 20.0 x { (0.16g / M) / (0.7739g/mL x 20mL x 10^-3)}
M으로 정리하면
1.1 x (0.7739g/mL x 20mL x 10^-3) / 20.0 = 0.16 / M
0.00085129 = 0.16 / M
M = 0.16 / 0.00085129
그러므로 M(미지시료 분자량) 은
187.9500523g/mol
7. 관찰과 결과 분석
7-1. 각각의 어는점이 다른 이유를 설명하시오.
-
제일큰 요인은 어는점 내림 계산시 용액마다 몰랄농도가 다르기 때문이다.
용액의 어는 점은 평형에서 순수한 용매 결정이 생성되기 시작하는 온도이다. 용액의 어는점은 순수한 액체의 어는점 보다 낮다.
어는점 내림은(델타 Tf)는 몰랄 어는점내림상수 x 용질의 몰랄농도에 정비례하는데
위에서는 용매가 다 사이클로헥세인으로 같아서 다른요인이 같다면 몰랄 어는점 내림상수는 같게 계산한다.
다만 나프탈렌 0.16g, 0.32g, 미지시료 0.16g 을 첨가했으므로 각각의 용액의 몰랄농도가 다르다.
그렇다면 각각의 용액의 어는점내림 계산시 달라질 수 밖에 없다.
7-2. Naphthalene과 분자량을 계산할 때 몰랄농도를 사용하는 이유를 설명하시오.
-
어는점 내림 계산식은 다음과 같다.
델타 T_f = K_f(몰랄 어는점 내림 상수) x m (용질의 몰랄농도)
좀더 풀어서 정리하면
델타 T_f = K_f(용매, 물질마다 다른 상수여서 정해진 값) x {용질의 몰수(mol)/ 용매의 질량(kg)}
= K_f(정해진 값) x { w(넣은 용질의 질량)/ M(분자량)} / { 용매의 부피(ml) x 용매의 밀도(g/ml) x 10^-3}
다음과 같이 계산하면 용액에 넣은 용질의 분자량을 제외한 모든 수를 구할수 있으므로 분자량을 계산 할 수있다.
7-3. 실험에서 계산으로 얻은 Naphthalene의 분자량과 실제 분자량의 오차율을 구하고 차이 가 나는 이유를 설명하시오.
-
1. 실험에서 계산으로 얻은 Naphthalene의 분자량
(129.2156609 + 111.7540851) / 2 = 120.484873 -
2. 실제 Naphthalene 분자량
128.1705 - 3. 오차율(%)계산
|이론값 - 실험값| x 100 / 이론값
|128.1705 - 120.484873| x 100 / 128.1705
=5.99(%) - 4. 차이나는 이유
4-1. 온도계로 온도를 측정할 때 소숫점 단위의 온도(6.0, 5.95도)를 육안으로 측정해야해 정밀하게 측정하지 못했다. 아마 이 부분에서 오차가 발생했을 것이다.
4-2. 30초마다 온도를 측정하긴 했지만 2분마다 용액을 저어줄때 온도계가 체온을 흡수하거나 실린더내의 공기와 섞여서 순간적으로 온도가 올라갔었다. 용액의 어는점을 측정하려면 온도기울기가 꺾이는 구간이 있는데 이때 정밀하게 측정하지 못했다.
4-3. 용액에 용질(나프탈렌)을 투여할때 실험실 위치가 에어컨앞이어서 저울의 숫자가 요동쳤다. 아마 넣은 용질의양이 정확히 1.6g이 아닐것이다. (몰랄농도에 영향) 또한 용질을 넣고 충분히 녹을때 까지 젓기는 했지만 완전히 해리되지는 않을수 있어 어는점내림에 온전히 관여하지 못했을 것이다.
4-4. 상온에서의 어는점을 기준으로 잡아야하는데 실험위치가 에어컨바람 앞에어서 아마 상온보다 낮은온도에서 실험이 진행되었던 것같다. 이때문에 실험의 오차가 발생 했을 것이다.
7-4. [관찰과 결과 분석] 미지시료 실험 결과를 토대로 미지시료를 추측하시오.
1. 벤조페논(182 g/mol) 2. 페놀(92 g/mol)
7-4A. 벤조페논(182g /mol), 계산한 값과 더 가깝고 어는점내림이 나프탈렌보다 작기 때문이다.
8. 후기
1. 사이클로헥세인 그냥 어는점이 6.8도 정도라 상온에서도 얼릴 수 있어서 신기했다 ㅋㅋ
2. 아침마다 실험하기 너무 힘들다
'일반화학실험 > 화학및 실험2(실험)' 카테고리의 다른 글
| [화학및 실험2] 3주차 결과보고서, 화학 반응 속도(시계반응) (2) | 2024.01.01 |
|---|---|
| [화학및 실험2] 3주차 예비보고서, 화학 반응 속도(시계반응) (0) | 2023.12.24 |
| [화학및 실험2] 2주차 예비보고서, 사이클로헥세인의 어는점 내림을 이용한 분자량 측정 (2) | 2023.12.16 |
| [화학및 실험2] 1주차 결과보고서, 기체의 확산 법칙 (1) | 2023.11.13 |
| [화학및 실험2] 1주차 예비보고서, 기체의 확산 법칙 (1) | 2023.11.13 |



