[실험 목적]
순수한 용매인 사이클로헥세인과 나프탈렌을 용해한 용액의 어는점을 측정하고 어는점 내림 현상을 이용하여 비휘발성, 비전해질인 나프탈렌의 분자량을 계산한다.
[실험 이론]
다음 실험 이론을 조사하시오.
1. 몰농도(molarity)와 몰랄농도(molality)에 대해 설명하시오.
1-1. 몰농도(molarity)
용액 중 용질의 몰 농도는 다음과 같이 정의한다.

몰농도= 용질의 몰수(mol) / 용액의리터수(L) [13.8]
예를 들어, 0.500mol의 Na2CO3를 충분한물에 용해시켜 0.250L의 용액을 만들면 Na2CO3 용액의 몰농도는 (0.500mol ) / ( 0.250L) = 2.00M 이다. 몰농도는 적정을 논의할 때 다룬 것 처럼, 용액의 부피를 그 부피에 포함된 용질의 양과 연관시킬 때 특별히 유용하다.
1-2. 몰랄농도(molality)
용액의 몰랄농도(molality)는 m으로 표시한다. m은 용질의 몰수에 기초한 농도단위이다. 몰랄 농도는 용매 1kg가 들어있는 용질의 몰수이다.

몰랄농도= 용질의 몰수 /용매의 kg수 [13.9]
따라서 0.200mol의 NaOH(8.00g)와 0.500kg(500g)의 물을 섞어 용액을 만들면, 그 용액의 NaOH 농도는(0.20mol)/(0.500kg)=0.400m(즉 0.400 몰랄농도)이다. 몰농도와 몰랄농도는 정의가 비슷해서 쉽게 혼동할 수 있다.
몰농도는 용액의 부피에 의존하고,
몰랄농도는 용매의 질량에 의존한다.
물이 용매일 때, 묽은 용액의 몰랄농도와 몰농도는 수치상으로 거의 같다. 왜냐하면 1kg 의 용매는 1kg의 용액과 거의 같고, 1kg의 용액은 거의 1L의 부피이기때문이다.
온도에 따라 질량이 변하지 않으므로, 용액의 몰랄농도는 온도의 영향을 받지 않는다. 그러나 온도변화에 따라 용액의 부피가 수축하거나 팽창하므로, 몰농도는 온도에 따라 변한다. 따라서 용액을 어떤 온도 범위 이상에서 사용하고자 할 때. 선택하는 농도의 단위는 몰랄농도이다.
출처: 브라운 일반화학 15판 13.4절 용액 농도 표시법 p606 ~ p608
2.[실험 이론] 총괄성의 공통적 특징과 어는점 내림에 대해 설명하시오.
2-1. 총괄성의 공통적 특징
용액의 어떤 물리적 성질들은 순수한 용매와 매우 다르다. 예를 들면 순수한 물은 0도씨인 반면에, 수용액은 그보다 낮은 온도에서 언다. 용액의 어는 점을 낮추기 위하여 에틸렌글리콜 부동액을 자동차의 라디에이터에 첨가하였을 때, 이러한 현상이 이용될 수 있다. 첨가된 용질은 용액의 끓는점을 순수한 물의 끓는점보다 높임으로써 높은 온도에서 엔진을 작동할 수 있게 한다.
어는점이 낮아지고 끓는점이 높아지는 것은 양(농도)에 비례하고 용질 입자의 종류와는 무관한 용액의 물리적성질이다. 이러한성질을 총괄성(coligativeproperty) 이라고한다(총괄은 집합에의 전한다는 의미이고. 총괄성은 용질 입자 수의 집합적 효과에 의존한다는 의미이다). 어는점내림과 끓는 점호를 이외에 증기압력내림과 삼투압도 총괄성이다. 용질의 농도가 이와 같은 성질에 정량적으로 어떻게 영향을 미치는지 살펴보고자 한다.
2-2. 어는점 내림
액체상과 고체상의 증기압력곡선은 삼중점에서 만난다.
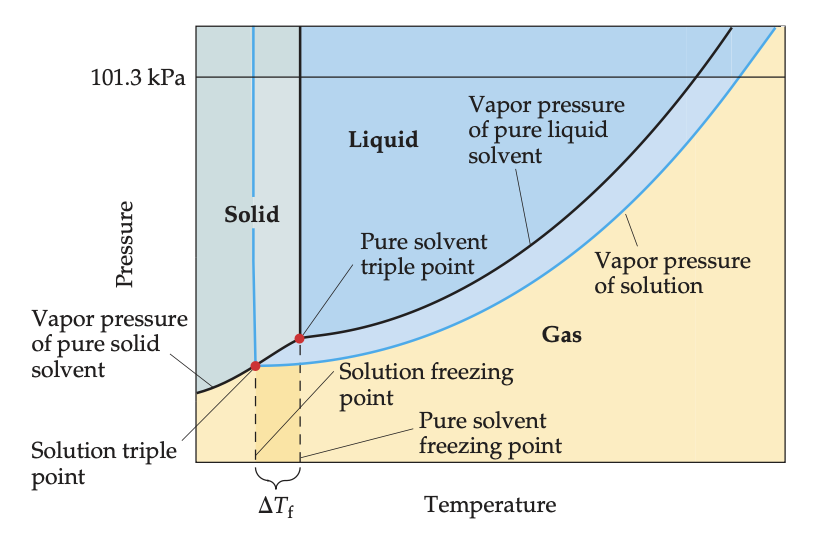
p615의 그림 [13.20]에서 용액의 삼중점 온도가 순수한 액체의 삼중점 온도보다 낮은 것을 볼 수 있다. 이는 용액 이순 수한 액체보다 낮은 증기압력을 갖기 때문이다.
용액의 어는점은 평형에서 순수한 용매 결정이 생성되기 시작하는 온도이다. 그림을 보면, 고체와 액체 사이의 평형을 나타내는 선은 삼중점으로부터 거의 수직으로 상승한다. [그림13.20]에서 용액의 삼 중 점 이 순수한 액체의 삼중점보다 낮다는 것을 쉽게 볼 수 있다. 또한 이것은 고체-액체 평형곡선을 따라 있는 모든 점에서 사실이다. 용액의 어는 점은 순수한 액체의 어는 점보다 낮다. 끓는점오름과 마찬가지로, 어는점내림(델타Tf)은 vant Hoff 지수(i)를 고려한 용질의 몰랄 농도에 정비례한다.
출처: 브라운 일반화학 15판 13.5절 총괄성 p611 ~ p614
3.[실험 이론] 어는점 내림상수와 어는점 내림을 이용한 몰질량 계산 방법에 대해 설명하시오
3-1. 어는점 내림 상수
표 13.3
| 용매 | 정상 상태 끓는 점 (°C) | 몰랄끓는점 오름상수 (Kb) | 정상 상태 어는 점 (°C) | 몰랄어는점 내림상수 (Kf) |
| 물 (H2O) | 100.0 | 0.51 | 0.0 | 1.86 |
| 벤젠 (C6H6) | 80.1 | 2.53 | 5.5 | 5.02 |
| 에탄올 (C2H5OH)| 78.4 | 1.22 | -114.6 | 1.99 |
| 사염화탄소 (CCl4)| 76.7 | 5.02 | -22.3 | 61.2 |
| 클로로폼 (CHCl3)| 61.2 | 5.12 | -63.5 | 3.63 |

비례상수 Kf는 몰랄 어는 점 내림 상수(molal freezing-point-depression constant)이다. 용액은 순수한 용매보다 낮은 온도에서 열기 때문에 델타Tf는 음의 값을 갖는다. 여러 일반적인 용매에 대한 Kb와 Kf의 값을 표13.3에 나타내었다. 표에서 물의 경우 Kb은 0.51로 나타나 있는데. 이것은 비휘발성 용질 입자가 1m로 녹아 있는 수용액의 끓는점이 순수한 용매의 끓는점 보다 0.51도C 높다는 것을 의미한다. 용액은 일반적으로 이상적으로 거동을 하지 않기 때문에 표13.3에 나타난 상수값은 묽은 용액에 잘 적용된다. 물의값은 1.86C/m이다. 따라서비휘발성용질입자1m수용액(1 m C6H12O6, 또는 0.5m NaCl과 같은)은 순수한 물의 어는점보다 1.86C 낮은 온도에서 언다.
용질에 의해 일어나는 용액의 어는 점 내림을 유용하게 활용한 예로, 겨울철에 자동차 부동액의 사용 및 도로의 결빙 방지에 염화칼슘(CaCl2)을 사용하는 것이 있다.
3-2. 어는점 내림을 이용한 몰질량 계산 방법
용액의 총괄성은 용질의 몰 질량을 측정하는 유용한 방법을 제공한다. 네 가지의 총괄성(증기압력 내림, 끓는점 오름, 어는점 내림, 삼투압)중 어느 것이라도 용질의 몰질량을 측정하는 데 사용할 수 있다. 이것은 예제13.10에 나타나 있다. 예제 13.10을 같이 풀어보자
예제 13.10
어는점 내림 또는 끓는점오름으로부터 몰 질량의 계산
문제: 40.0g의 CCl4 0.250 g를 녹여 미지의 비휘발성 비전해질 용액을 만들었다. 이 용액의 정상 끓는점은 순수한 용매의 끓는 점보다 0.357도C 더 높다. 용질의 몰 질량을 계산하시오
풀이
1. 델타Tb = i x Kb x m 를 사용해서 몰랄농도를 먼저 구하자
몰랄농도(m) = 델타Tb / (i x Kb)
= 0.357 / (1 x 5.02)
=0.0711m
2.따라서 용액은 용매 kg당 용질 0.0711mol을 포함한다. 용액은 용매(CCl4) 40.0g = 0.0400kg 을 사용하여 만든다. 따라서 용액 중 용질의 몰 수는
0.0400 kg x 0.0711 mol/kg = 2.84 x 10^-3 mol
3. 용질의 몰질량은 그 물질의 몰당 그램수이다.
몰질량 = 0.250g / 2.84x10^-3mol
= 88.0 g/mol
위의 문제에서는 끓는점 오름으로 몰질량을 계산하였지만 어는점 내림을 활용하여 같은 방법으로 미지시료의 몰질량을 계산할 수있다.
1. 용매의 어는점 내림 상수를 표에서 찾고 어는점이 얼만큼 내려갔는지 확인한다.
2. 위의 정보를 통해 델타 Tf = - i x Kf x m 에 대입하여 용액의 몰랄농도를 알아낸다.
3. 용액의 질량을 통해서 용질의 몰수를 계산한다.
4. 용질의 몰수를 알아냈으면 (w/M) 미지 용질의 질량을 용질의 몰수로 나누어서 용질의 몰질량을 계산하자
그러면 미지시료의 몰질량을 알아 낼 수 있다.
출처: 브라운 일반화학 15판 13.5절 총괄성 p619 ~ p620
후 방법은 예제 13.10을 요약함
4.[기구와 시약] 위 시약들의 물리적, 화학적 특성과 그 위험성에 대해 조사하시오. (원자량, 녹는점, 끓는점 포함)
기구: 스탠드, 클램프, 시험관, 온도계, 1000 mL 비커, 10 mL 메스실린더, 탈지면, 타이머, 얼음
시약 : Naphthalene, Cyclohexane
나프탈렌(Naphthalene)
CAS 번호: 91-20-3
KE 번호: KE-25545
물리적 특성:
물질 성상: 다양한 형태의 고체
분자량: 128.17 g/mol
녹는 점: 80 도C
끓는 점: 218 도C
인화점: 174 F(화씨)
화학적 특성:
나프탈렌은 분자식 C10H8를 가지며, 고체 상태에서 백색 결정체입니다.
방향족 화합물으로, 고리 구조를 가지고 있습니다.
위험성 및 주의사항:
나프탈렌은 고체 상태에서 고온, 화염, 스파크 등 열 및 불에 민감하며 인화성이 있습니다. 따라서 높은 열과 화염으로부터 멀리해야 합니다.
먹었을 경우 유해하며 즉시 의료 조치가 필요합니다.
피부 또는 눈과 접촉 시 즉시 흐르는 물로 세척해야 하며, 피부에 고착된 경우 의료 지원이 필요할 수 있습니다.
공기 중에 미세한 입자로 흩어져 있을 경우 화재 및 폭발의 위험이 있으므로 모든 점화원을 제거해야 합니다.
나프탈렌은 수생생물에게 매우 유독할 수 있으며, 장기적인 영향을 미칠 수 있습니다.
안전 조치로는 개인 보호구 착용, 금연, 배기설비 가동, 용기 밀폐, 화기엄금 등을 준수해야 합니다.
Cyclohexane
CAS 번호: 110-82-7
KE 번호: KE-18562
물질 성상: 액체
분자량: 84.16 g/mol
녹는 점: 6.5 도C
끓는 점: 80.7 도C
인화점: -20 도C
위험성및 주의사항:
시클로헥산은 환기가 잘 되는 곳에 보관하고 저온으로 유지해야 합니다.
물질은 열, 스파크, 화염, 고열로부터 멀리하고 금연해야 합니다.
시클로헥산은 졸음 또는 현기증을 일으킬 수 있으므로 조심해야 합니다.
피부에 자극을 일으키고, 눈에 심한 자극을 일으킬 수 있으므로 물질과의 접촉을 피해야 합니다.
눈에 묻었을 경우, 즉시 몇 분간 물로 씻어내야 하며, 가능하면 콘택트렌즈를 제거해야 합니다.
먹었을 경우 치명적일 수 있으며, 의료 기관의 진찰이 필요합니다.
모든 점화원을 제거하고 접지된 장비를 사용해야 합니다.
시클로헥산은 수생생물에게 매우 유독하며, 장기적인 영향을 미칠 수 있습니다.
시클로헥산은 안전 조치 및 개인 보호구 착용이 필요한 물질로, 안전 조치 및 규정을 준수하여 다루어야 합니다. 이 정보는 물질의 물리적 특성과 위험성에 대한 이해를 돕고, 안전한 다루기에 도움이 됩니다.
출처: MSDS 물질검색 검색어 ,'나프탈렌','시클로헥산' 검색후 정리및 요약
5.[실험 방법] 이때 Cyclohexane 30 mL으로 위 실험을 진행하였을 때, 어는점이 6.47 ℃ 이었다.
Naphthalene 0.5 g을 넣은 뒤 실험을 진행하였을 때, Cyclohexane + Naphthalene 0.5 g의 어는점은 몇 도(℃)인가? 이때 소수점 아래 둘째 자리까지 계산하시오.
실험의 간략한 과정은 다음과 같다.
1) 메스실린더를 이용하여 cyclohexane 20 mL를 시험관에 넣는다.
2) 스티로폼 실린더에 얼음을 채워 넣는다.
3) 어는점 내림 측정을 위한 장치를 설치한다.
*온도계는 시험관 벽에 닿지 않도록 솜으로 고정한다.
4) 상온에서 3분 기다리고 cyclohexane의 온도를 측정하여 기록한다.
5) 클램프에 시험관을 고정시키고 얼음에 담근다.
6) 온도계를 좌우상하로 저으며 cyclohexane의 온도를 30초 간격으로 읽어 기록한다.
7) 온도가 일정하다가 강하할 때까지 측정한다.
8) Cyclohexane에 Naphthalene 0.16 g을 넣어 위 실험을 반복한다.
9) Cyclohexane에 Naphthalene 0.32 g을 넣어 위 실험을 반복한다.
10) 나프탈렌 대신 미지시료 0.16g을 넣고 같은 실험을 반복한다.
물의 밀도 : 1.00 g/mL,
물의 어는점 내림 상수(Kf) : 1.86
Cyclohexane의 밀도 : 0.779 g/mL
Cyclohexane의 어는점 내림 상수(Kf) : 20.2
Naphthalene의 분자량 : 128.17 g/ml
(답안 예시 : 2.34)
5-A.
정답: 6.13
6. 출처
https://msds.kosha.or.kr/MSDSInfo/kcic/msdssearchMsds.do
안전보건공단 화학물질정보 | MSDS검색
본문내용 산업안전보건법 제110조 및 111조에 의거 유통되는 화학물질 및 화학물질을 함유한 제제의 물질안전보건자료(MSDS)는 해당 물질을 양도하거나 제공(제조·수입·판매자(도·소매업자))하
msds.kosha.or.kr
https://product.kyobobook.co.kr/detail/S000200598129
Brown 일반화학 세트 | Theodore L. Brown - 교보문고
Brown 일반화학 세트 | 일반화학은 여러 학문의 기반이 된다. 다루는 주제와 범위가 넓어지고, 일반화학을 필요로 하는 전공이 많아졌다. 이에 따라 일반화학 교재의 종류도 다양해졌다. T. L. Brown
product.kyobobook.co.kr
'일반화학실험 > 화학및 실험2(실험)' 카테고리의 다른 글
| [화학및 실험2] 3주차 결과보고서, 화학 반응 속도(시계반응) (2) | 2024.01.01 |
|---|---|
| [화학및 실험2] 3주차 예비보고서, 화학 반응 속도(시계반응) (0) | 2023.12.24 |
| [화학및 실험2] 2주차 결과보고서, 사이클로헥세인의 어는점 내림을 이용한 분자량 측정 (0) | 2023.12.17 |
| [화학및 실험2] 1주차 결과보고서, 기체의 확산 법칙 (1) | 2023.11.13 |
| [화학및 실험2] 1주차 예비보고서, 기체의 확산 법칙 (1) | 2023.11.13 |



