예비군 이슈로 실험을 못함 ㅠㅠㅠㅠㅠ
(실험 사진이 없다는 말...)
감점도 많이 당해서 기분이 별로인 주차입니다.

1. 실험 목적
화학반응에서 발산되거나 흡수되는 반응열의 측정을 통하여 비열과 열용량의 개념 을 이해하고 그 응용성을 생각해본다.
2. 실험 이론
<조사할 내용>
1 비열과 열용량에 대해 조사
2 화학반응의 엔탈피(발열반응, 흡열반응)에 대해서 조사
3 에너지의 단위에 대해서 조사
4 용해도와 포화, 과포화상태에 대해서 조사
(6주차 예비보고서에서 작성)
https://devlawyer.tistory.com/20
[화학및 실험1] 6주차 예비보고서, 주머니 난로의 열량 측정
[실험 제목] 주머니 난로의 열량 측정 [실험 목적] 화학반응에서 발산되거나 흡수되는 반응열의 측정을 통하여 비열과 열용량의 개념을 이해하고 그 응용성을 생각해본다. [실험 이론] 다음 실험
devlawyer.tistory.com
3. 실험방법
1) 주머니 손난로의 무게를 잰다.
2) 원형 스티로폼 단열재에 증류수를 225mL넣는다.
3) 원형 스티로폼의 뚜껑에 온도계를 고정시키고 뚜껑을 닫는다.
(안의 열이 빠져나가지 않도록 뚜껑을 누르고 있도록 한다)
4) 증류수의 온도변화가 없을 때까지 기다린 후 온도를 측정한다. (5분가량)
5) 뚜껑을 열고 발열을 시킨 주머니 난로를 재빠르게 넣는다.
(이 때, 온도계가 직접적으로 주머니 난로에 닿지 않도록 한다)
6) 온도변화가 없을 때까지 30초~1분 간격으로 온도를 측정한다.
(원형 스티로폼을 20초에 한번씩 흔들어서 열이 골고루 전달되도록 한다)
7) 에탄올 225mL로 같은 실험을 한다.
4. 기구와 시약
주머니 난로(Sodium Acetate), 원형 스트로폼 단열재, 온도계, 메스실린더, 에탄올, 초시계
5. 실험 과정
(예비군 issue~ 로 사진이 없습니다 ㅠㅠ)

6. 실험 결과

※ 시판되는 주머니난로의 성분은 아세트산나트륨과 염화나트륨, 물이 들어있다.
아세트산나트륨은 전부 삼수화물의 형태로 재결정된다고 하면, CH3COONa∙3H2O과 NaCl의 질량비 에 의해 CH3COONa∙3H2O은 성분 전체 무게 중 70%를 차지한다.
* 주머니 난로 안의 아세트산소듐삼수화물만의 양 = {주머니 손난로 전체 무게-(포장비닐+금속판 의 무게)} X 0.7} 로 계산해야함
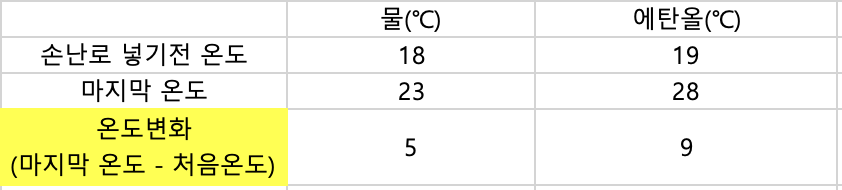
6-1. 물 에서의 온도 변화를 이용하여 주머니 난로에서 발생되는 열량(cal)을 계산하시오. (계산 과정 필수)(물의 비열 : 1cal /g∙℃ 밀도 : 1g/mL )
-
물의 밀도 = 물의 질량 / 물의 부피
1g/mL = 물의 질량 / 255mL
물의 질량 = 255g
C(비열) x m(질량) x 델타t (온도변화) = Q(열량)
1cal /g 도C x 255g x 5 도C = 1275cal
6-2. 에탄올에서의 온도 변화를 이용하여 주머니 난로에서 발생되는 열량(cal)을 계산하시오. (계산 과정 필수)(에탄올의 비열 : 0.577cal/g∙℃ 밀도 : 0.78g/mL)
-
에탄올의 밀도 = 에탄올의 질량 / 에탄올의 부피
0.78g/mL = 에탄올의 질량 / 225mL
에탄올의 질량 =175.5g
C(비열) x m(질량) x 델타t(온도변화) = Q(열량)
0.577cal/g 도C x 175.5g x 9도C = 911.372cal
6-3. 주머니 난로의 발열 반응은 다음과 같다.
CH3COO⁻ + Na⁺ + 3H2O → CH3COONa∙3H2O
이 때, ΔHc (Heat of crystallization)이 145 J/g이라면, 실험에 사용된 주머니 난로에서 발생할 수 있는 이론적인 열량(cal)은 물에 대해 얼마인가? (계산 과정 필수)
-
아세트산소듐삼수화물의 질량이 37.403 g이므로
37.403 g의 아세트산쇼듐삼수화물에 대해 발생하는 이론적인 열량은
37.403 g × 145 J/g = 5423.435 J
이론적인 열량을 cal 단위로 변환하면
5423.435 J / 4.184 J/cal =~ 1296.232 cal
6-4. 주머니 난로의 발열 반응은 다음과 같다.
CH3COO⁻ + Na⁺ + 3H2O → CH3COONa∙3H2O
이 때, ΔHc (Heat of crystallization)이 145 J/g이라면, 실험에 사용된 주머니 난로에서 발생할 수 있는 이론적인 열량(cal)은 에탄올에 대해 얼마인가? (계산 과정 필수)
-
아세트산소듐삼수화물의 질량이 31.248 g이므로
31.248 g의 아세트산소듐삼수화물에 대해 발생하는 이론적인 열량은
31.248 g × 145 J/g = 4530.96 J
이론적인 열량을 cal 단위로 변환하면
4530.96 J / 4.184 J/cal =~ 1082.93 cal
6-5. 6-3. 및 6-4.번의 결과(실험값)와 5번 및 6번의 결과(이론값)가 다른 이유를 서술하시오.
-
오차율 계산
6-3번(이론값)과 6-1번(실험값)
|1296.232 cal- 1275cal| x 100% / 1296.232 cal ~= 1.638%
6-4번(이론값)과 6-2번(실험값)
|1082.93 cal - 911.372cal| x 100% / 1082.93 cal~= 15.8420%
이론값이 실험값보다 대체로 큰 것을 보면 열이 다른 물질에 흡수되었을 가능성이 크다.
1. 외부와 열에너지가 전달되지 않도록 스티로폼 단열재를 사용했지만
스티로폼 단열재 자체가 열을 조금이라도 흡수했을 것이다.
2. 온도계와 손난로가 닿지 않도록 뚜껑을 열고 닫아 조정하는 과정에서 손난로가 방출한 열의 일부가 외부로 새어나갈수도 있기 때문에 오차가 발생했을 것이다.
3. 손난로안의 아세트산소듐삼수화물이 반응하면서 열을 방출하였지만 열이 모두 물의 온도를 올리는데 사용된 것이 아니라 내부의 금속판이나 손난로의 비닐 온도를 올리는데 사용되어 열량에 오차가 발생했을 것이다.
4. 손난로가 오래되어 제기능을 하지 못해 방출되는 열 자체가 적었던 것 같다.
6-6. 주머니 난로 원리와 마찬가지로 화학 반응을 이용하여 여름에 사용할 수 잇는 아이스팩이 가능한지 생각하고, 가능하다면 또는 불가능하다면 이유를 적어보시오.
-
주머니 난로는 아세트산소듐의 결정화반응을 발열반응으로 유도하여 주위를 따뜻하게 만드는 원리를 이용한 것이다.
반대로 흡열반응을 이용하여 주변 열을 흡수하여 여름에 사용할 수있는 아이스팩을 만들 수 있다.
다음은 질산 암모늄과 물을 섞으면 일어나는 흡열반응이다,
NH4NO3(s) -> NH4+(aq) + NO3-(aq)
이반응은 주변 열을 흡수해 여름에 사용할 수 있는 아이스팩으로 활용할수 있다.
또한 열용량이 매우 큰 물질(예를들어 폴리에틸글리콜 Polyethylene glycol, H-(O-CH2_CH2)n-OH )
은 외부에 대하여 큰 열을 받아야만 온도가 변하기 때문에 한번 차갑게 만들면 온도를 유지하기가 열용량이 적은 물질보다 비교적 쉽다.
열용량이 큰 물질을 차가운 상태로 만들어 두면 이를 아이스팩으로 활용할 수 있을 것이다.
7. 6주차 후기
7-1. 다시한번 말하지만 예비군 이슈 때문에 너무 아쉽다.
7-2.주머니 난로 안의 아세트산소듐삼수화물만의 양 = {주머니 손난로 전체 무게-(포장비닐+금속판 의 무게)} X 0.7}
이거 계산할때 괄호 잘보기...
7-3. 화2 교과서에도 있는, 기억상에 중학교 교육과정에도 있는 유명한 실험임!
7-4. (Q는 시멘트ㅎㅎ)

'일반화학실험 > 화학및 실험1(실험)' 카테고리의 다른 글
| [화학및 실험1] 7주차 결과보고서, 미지시료에 포함된 양이온의 정성분석 (1) | 2023.06.19 |
|---|---|
| [화학및 실험1] 7주차 예비보고서, 미지시료에 포함된 양이온의 정성분석 (2) | 2023.06.19 |
| [화학및 실험1] 6주차 예비보고서, 주머니 난로의 열량 측정 (1) | 2023.06.17 |
| [화학및 실험1] 5주차 결과보고서, 금속의 활동도 서열 결정 (5) | 2023.06.16 |
| [화학및 실험1] 5주차 예비보고서, 금속의 활동도 서열 결정 (1) | 2023.05.12 |



