1. 실험 목적
화학 전지의 제작과 전위차 측정
2. 실험 이론
• 이론으로 조사해야 할 것들
- 1) 화학전지
- 2) Nernst 식
- 3) 표준 환원 전위, 전지전위 계산
- 4) 다니엘 전지
(2-9주차 예비보고서에서 작성)
https://devlawyer.tistory.com/73
[화학및 실험2] 9주차 예비보고서, 화학전지의 제작과 전위차
[실험 제목]화학 전지의 제작과 전위차 측정 [실험 목적]자발적으로 일어나는 전자 이동 반응을 이용하여 전기 에너지를 얻는 화학 전지 반응의 원리를 익히고 화학 전지를 제작하여 전위차를
devlawyer.tistory.com
3. 실험 방법
1) 구리와 아연판을 측정 전에 사포로 문질러 광택이 나도록 한 뒤, 증류수로 표면을 세척한다.
2) 후드에 있는 Zn(NO3)2 1 M 과 Cu(NO3)2 1 M 용액을 사용하여, Zn(NO3)2 0.1 M 용액과 Cu(NO3)2 0.1 M 용액을 각각 100 mL씩 제조한다.
Zn(NO3)2 0.1 M 용액 제조방법: Zn(NO3)2 1 M 용액 10 mL를 100 mL 부피플라스크에 넣고 표선까지 증류수로 묽힌다.
Cu(NO3)2 0.1 M 용액 제조방법: Cu(NO3)2 1 M 용액 10 mL를 100 mL 부피플라스크에 넣고 표선까지 증류수로 묽힌다.
3) Cu(NO3)2 0.1 M 용액을 사용하여, Cu(NO3)2 0.01 M, 0.001 M 용액을 각각 100 mL씩 제조한다.
4) Zn(NO3)2 0.1 M 용액과 Cu(NO3)2 0.001 M 용액을 각각 30 mL씩 100 mL 비커에 넣는다.
5) 아래의 그림과 같이 장치한다.
Cu(NO3)2 0.01 M 용액 제조방법: Cu(NO3)2 0.1 M 용액 10 mL를 100 mL 부피플라스크에 넣고 표선까지 증류수로 묽힌다.
Cu(NO3)2 0.001 M 용액 제조방법: Cu(NO3)2 0.01 M 용액 10 mL를 100 mL 부피플라스크에 넣고 표선까지 증류수로 묽힌다.
4) Zn(NO3)2 0.1 M 용액과 Cu(NO3)2 0.001 M 용액을 각각 30 mL씩 100 mL 비커에 넣는다.
5) 아래의 그림과 같이 장치한다.
6) 전압계의 전원을 켜고 전압계의 빨간색 클립은 구리판에, 검은색 클립은 아연판에 연결한다.
7) 아연판은 Zn(NO3)2 용액에, 구리는 Cu(NO3)2 용액에 약 1 cm씩 담근 후 전압을 측정한다.
8) 4)~7)의 과정을 Cu(NO3)2 용액의 농도를 0.01M, 0.1M 높여가며 반복한다. (Zn(NO3)2 용액의 농도는 변함없이 0.1 M 로 고정한다).
* 주의사항 *
- 염다리의 양쪽 끝 부분(젤리 형태)이 용액에 잘 담기도록 한다.
- 전압계의 다이얼을 4 V로 맞추어 놓고 측정한다.
- 집게 전선은 용액에 넣지 않도록 한다. (녹 방지)
- 용액에 잠기는 금속판의 면적이 최대한 같도록 한다.
- 전위가 조금씩 변하면 제일 높은 전위를 기록한다.
- 용액은 묽은 농도부터 측정한다.
- 폐시약은 폐수통에 버리고 금속은 회수한다.
4. 기구와 시약
Cu(NO3)2 1 M 용액, Zn(NO3)2 1 M 용액, 아연판, 구리판, 염다리, 사포, 전압계, 비커, 메스실린더
5. 실험 과정




6. 실험 결과
6-1. 위 표의 (1) - (3) 빈칸을 채우시오. 각 금속의 표준 환원 전위는 아래 표를 참고하고, 소수점 아래 둘째 자리까지 계산하시오.
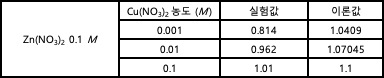
6-2. 1-2) 위 표의 (4) - (6) 빈칸을 채우시오.
7. 관찰과 결과분석
7-1. 실험결과 1-1) 문제의 이론값을 계산하기 위한 풀이 과정을 서술하시오.
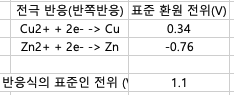
위의 갈바니 전지에서 전체 반응식은 다음과 같다
> 산화 반응: Zn(s) → Zn^2+(aq) + 2e^- E° = -0.76V
> 환원 반응: Cu^2+(aq) + 2e^- → Cu(s) E° = 0.34V
> 전체반응식 : Zn(s) + Cu^2+(aq) → Zn^2+(aq) + Cu(s)
E°_cell = E°_red(환원전극) – E°_red(산화전극)
E°_cell = 0.34V - (-0.76V)
= 1.1V
네른스트식을 사용하면
E = E° – (0.0592 V / n) × logQ
E = 1.1V – (0.0592 V / 2 x log([Zn^2+] / [Cu^2+])
(1)
= 1.1V – (0.0592 V / 2 x log(0.1 / 0.001)
= 1.0409
(2)
= 1.1V – (0.0592 V / 2 x log(0.1 / 0.01)
= 1.07045
(3)
= 1.1V – (0.0592 V / 2 x log(0.1 / 0.1)
= 1.0409
7-2. 염다리에 역할에 대해 서술하시오.
전극을 수용액에 넣고 이온들이 소모되기 시작하면
1) 묽은 황산아연 수용액이 들어있는 비커에서는
용해된 Zn^2+(aq) 때문에 수용액의 (+) 전하가 증가한다.
( 황산이온, SO4^2-(aq)의 농도는 처음 상태 그대로 이기 때문에 )
( 전하 불균형 상태 )
그냥 두면 아연이 더 이상 용해되지 않는다.
( 수용액의 (+) 전하와 Zn^2+ 사이의 반발력 때문에 )
이때 염다리의 (–) 성분이 이동하여 전지를 중성화시킨다.
그러면 계속해서 아연이 용해된다.
2) 묽은 황산구리 수용액이 들어있는 비커에서는
석출된 구리 때문에 수용액의 (–) 전하가 증가한다.
( 황산이온, SO4^2-(aq)의 농도는 처음 상태 그대로 이기 때문에 )
( 전하 불균형 상태 )
그냥 두면 구리가 더 이상 석출되지 않는다.
( 수용액의 (–) 전하와 Cu^2+ 사이의 인력 때문에 )
이때 염다리의 (+) 성분이 이동하여 전지를 중성화시킨다.
그러면 계속해서 구리가 석출된다.
염다리
염다리는 전기화학에서 두 반쪽 전지 (갈바니 전지)를 연결할 때 쓰이는 장치이다.
염다리는 염다리의 양이온이 환원전극 쪽으로 이동하고 음이온은 환원전극에서 염다리 쪽으로 이동시켜 전하의 축적을 정확히 상쇄해 빠르게 평형을 이루는 내부 회로의 전기적 중성을 유지한다.
만약 염다리를 사용하지 않을경우 전지 반응의 진행에 따라 한 곳의 반쪽 전지에는 양전하가, 반대쪽의 반쪽 전지에는 음전하가 축적되게 되고, 이내 반응이 중지됨으로써 전기의 생산 역시 중단된다.
염다리는 전해질로 채워진 U자관으로 이루어져 있다. 전해질은 염화 포타슘이나 염화 소듐이 주로 사용된다. 이 외에도 염다리를 만들 수 있는 전해질의 종류는 많지만 다음과 같은 조건을 충족해야 한다.
전지 반응과 무관한 이온으로 구성되어야 한다.
양전하와 음전하의 전도성이 비슷하고, 따라서 둘이 비슷한 이동 속도를 가져야 한다.
전기가 잘 통하고 이동도가 변하지 않는 것이 좋다.
염다리의 전도도는 주로 전해액의 농도에 의존한다. 포화점 이하의 농도에서 전해액의 농도를 높이면 전도도가 증가하고, 과포화 상태의 전해질을 사용하거나 좁은 직경의 튜브를 사용하면 낮은 전도도를 보인다.
염다리의 농도가 반쪽 전지의 농도보다 매우 크기 때문에 이온의 이동은 염다리 밖으로의 이동이 염다리 안으로의 이동보다 훨씬 많다.
산화전극에서 나온 금속이온 중 아주 소량은 양전하의 축적을 방지하기 위하여 염다리 안으로 이동한다.
출처: 위키백과 검색어 <염다리>
7-3. 각 용액에 전극을 계속 담가 놓는다면 시간이 지날수록 전위차가 어떻게 변할지 예측하고, 그 이유를 서술하시오.
네른스트식에 의하면
E = E° – (0.0592 V / n) × logQ
E = 1.1V – (0.0592 V / 2 x log([Zn^2+] / [Cu^2+]) 일때
구리판에서 계속해서 구리가 석출되면서 구리이온수가 줄고
아연 전극에서는 계속해서 아연이 이온화되면서 아연 이온수가 늘어나게 된다.
그러므로 네른스트식을 사용해서 설명하면
반응이 지나면 지날수록
E = 1.1V – (0.0592 V / 2 x log([Zn^2+] / [Cu^2+])
E = 1.1V – (0.0592 V / 2 x log(증가 / 감소)
시간이 지나면 E (전위차) 는 감소하게된다
7-4. 만일 아연 전극을 은 전극으로 바꾸어 실험을 진행할 경우, 전지는 어떻게 되는지 서줄하시오.
은의 표준환원전위는 다음과 같다.
Ag^2+ + e^- → Ag^+ E° = +1.99 V
Ag의 표준환원전위가 Cu의 표준환원전위보다 크므로 은을 환원전극으로 사용해야한다.
산화환원 반응식을 작성하면
> 산화 반응: Cu(s) →Cu^2+(aq) + 2e^- E° = +0.34 V
> 환원 반응: (Ag^2+ + e^- → Ag^+ ) x2 E° = +1.99 V
> 전체반응식 : Zn(s) + Cu^2+(aq) → Zn^2+(aq) + Cu(s)
E°_cell = E°_red(환원전극) – E°_red(산화전극)
E°_cell = 1.99 V - 0.34 V
= 1.65V
Cu(s)|Cu2+(aq)||Ag2+(aq)|Ag(s)
'일반화학실험 > 화학및 실험2(실험)' 카테고리의 다른 글
| [화학및 실험2] 10주차 예비보고서, 비누 만들기 (1) | 2025.10.07 |
|---|---|
| [화학및 실험2] 9주차 예비보고서, 화학전지의 제작과 전위차 측정 (0) | 2025.03.17 |
| [화학및 실험2] 8주차 결과보고서, 일감호 수질 검사 : 화학적 산소 요구량 (COD) 측정 (0) | 2025.03.16 |
| [화학및 실험2] 8주차 예비보고서, 일감호 수질 검사 : 화학적 산소 요구량 (COD) 측정 (0) | 2025.03.13 |
| [화학및 실험2] 7주차 결과보고서, 식초와 아스피린의 정량분석 (0) | 2025.03.13 |



