1. 실험 목적
완충 용액의 pH 변화를 통해 완충작용과 완충용량에 대해서 알아본다.
2. 실험 이론
<완충용액 (Buffer solution)>
완충용액은 약한 산과 그 짝 염기로 구성되어 있으며 pH가 거의 변하지 않는 용액을 말한다. 약산과 그 염의 혼합용액 또는 약염기와 그 염의 혼합 용액은 약산과 약염기의 해리특성에 의하여 그 pH가 변화하지 않는다. 적당한 산이나 염기를 그들의 염과 반응하면 적당한 pH를 나타내는 완충용액을 조제할 수 있는데 이는 생물 완충 등 다양한 방면에서 매우 중요하다. 예를 들면, 혈장은 pH의 변화가 0.2 이내로 유지하는 거의 완벽하고 이상적인 완충용액이다. 즉 혈장의 pH는 7.2~7.3으로 유지되고 있는데 이 pH에서 멀어지면 생명이 유지되지 못한다. 또한 일정한 pH에서 생체 촉매인 효소의 촉매작용도 최대가 된다.
일반적으로 완충용액은 약산과 그의 염 또는 약염기와 그의 염을 혼합해서 만든다. 완충용액에는 해리하지 않은 약산(또는 약염기)과 염의 해리해서 생기는 짝염기(또는 짝산)가 혼합되어 있다. 약산과 짝염기로 만들어진 완충용액에 다른 산이나 염기를 넣어주면, 넣어준 산이 해리해서 생긴 수소 이온은 짝염기와 결합하여 약산이 되고, 넣어준 염기는 해리하지 않은 상태의 약산을 해리시켜 수소 이온을 보충하기 때문에 용액의 수소 이온의 농도는 크게 변하지 않는다. 아세트산과 아세트산나트륨을 섞어서 만든 HAc-Ac- 완충용액을 예로 완충 작용에 대해 좀더 생각해보자. 물 속에서 아세트산은 아세트산 이온과 다음과 같은 평형을 이루게 된다.
< 완충용액에서의 반응식>
① 완충용액에서는 아세트산과 그 짝염기인 아세트산 이온이 평형을 이루고 있다.
CH3COOH (aq) + H2O (l) ⇄ CH3COO- (aq) + H3O+ (aq)
② 완충용액에 강산을 가해도, 아세트산 이온이 수소 이온과 반응해서 아세트산을 생성하면서 수소 이온의 농도가 별로 증가하지 않는다.
CH3COO- (aq) + H3O+ (aq) ⇄ CH3COOH (aq) + H2O (l)
③ 완충용액에 강염기의 수산화 이온을 가해도 아세트산이 첨가된 수산화 이온과 반응해서 수산화 이온의 농도가 별로 증가하지 않는다.
CH3COOH (aq) + OH- (aq) ⇄ CH3COO- (aq) + H2O (l)
이 용액에 아세트산 이온을 넣어주면 르샤틀리에의 원리에 의해서 역반응이 진행되어서 아세트산이 만들어지고, 수소 이온의 농도는 감소하게 된다. 마찬가지로 외부에서 넣어준 산에 의해서 용액의 수소 이온 농도가 커지면, 역반응이 진행되어 아세트산이 생기면서 수소 이온 농도의 증가를 줄여준다. 또한 외부에서 염기를 넣어서 용액 속의 수소 이온 농도가 감소하게 되면 정반응이 일어나서 용액 속의 아세트산이 해리됨으로써 수소 이온 농도의 감소를 막아주게 된다. 이처럼 완충용액에는 외부에서 넣어준 산이나 염기에 의한 수소 이온 농도의 변화를 완충시켜 주는 역할을 할 수 있는 아세트산과 아세트산 이온이 충분히 들어있어야 한다.
완충용액의 pH는 아세트산의 산해리 상수(1.75 x 10-5) 및 아세트산 이온과 아세트산의 농도비에 의해서 결정된다. 산이나 염기를 넣어주어도 아세트산 이온과 아세트산의 농도비가 많이 바뀌지 않기 때문에 완충 효과가 나타난다. 특히 아세트산과 아세트산 이온의 양이 넣어준 산이나 염기의 양보다 훨씬 많을 경우에는 완충 효과가 더 잘 나타난다. 그리고 아세트산과 아세트산 이온의 농도가 같으면 pH는 pKa(아세트산의 경우 4.76)가 되고, 완충 효과가 가장 잘 나타난다.
*조사할 내용*
1) 완충용량
2) Henderson-Hasselbalch 식
(2-7주차 예비보고서에서 작성)
https://devlawyer.tistory.com/67
[화학및 실험2] 7주차 결과보고서, 완충용액의 효과와 용량
[실험 제목]완충용액의 효과와 용량 확인 [실험 목적]완충 용액의 pH 변화를 통해 완충작용과 완충용량에 대해서 알아본다. [실험 이론]다음 실험 이론을 조사하시오.1. 완충 용량에 대해 설명하
devlawyer.tistory.com
3. 실험 방법
[실험 1] 증류수에서 pH 변화를 살펴본다.
① 증류수 50 mL을 비커에 담은 후 pH를 측정한다.
② 증류수 50 mL에 0.1 M NaOH 1.0 mL를 첨가하여 pH를 측정한다.
③ 증류수 50 mL에 0.1 M HCl 1.0 mL를 첨가하여 pH를 측정한다.
[실험 2] 완충용액을 만들고 완충효과를 알아본다.
① 0.1M CH3COOH 용액 만들기: 1 M CH3COOH 10 mL를 취하여 100mL 부피 플라스크에 넣고 증류수로 표시선까지 채운다. (1/10로 묽힌다.)
② 0.1M CH3COONa 용액 만들기: 1 M CH3COONa 10 mL를 취하여 100mL 부피 플라스크에 넣고 증류수로 표시선까지 채운다. (1/10로 묽힌다.)
③ 비커에 0.1 M CH3COOH 25 mL와 0.1 M CH3COONa 25 mL를 잘 섞고 pH를 측정한다.
(2개 만들 것)
④ ③용액에 0.1 M NaOH용액 1.0 mL를 첨가하여 pH를 측정한다.
⑤ 다른 하나의 ③용액에는 0.1 M HCl용액 1.0 mL를 첨가하여 pH를 측정한다.
[실험 3] 0.1 M 용액으로 만든 완충용액의 완충용량 확인
① 0.1M CH3COOH 5.0 mL와 0.1M CH3COONa 5.0 mL를 섞은 용액 2개를 만든다.
② 하나에는 0.1M NaOH용액 5.0 mL를 첨가하고, 다른 하나에는 0.1M HCl용액 5.0 mL를 첨가하여 pH를 각각 측정한다.
[실험 4]
① 1M CH3COOH 5.0 mL와 1M CH3COONa 5.0 mL를 섞은 용액 2개를 만든다.
② 하나에는 0.1M NaOH용액 5.0 mL를 첨가하고, 다른 하나에는 0.1M HCl용액 5.0 mL를 첨가하여 pH를 각각 측정한다.
4. 기구와 시약
* 기구 - 100mL 부피 플라스크, 비커, 유리막대, 핀셋, 메스실린더, pH paper
* 시약 - 1M CH3COOH, 1M CH3COONa, 0.1M CH3COOH, 0.1M CH3COONa, 0.1M NaOH, 0.1M HCl
| ☞ Safety note | |
| CH3COONa | 눈, 피부, 점막에 자극을 줄 수 있으므로 주의한다. |
| CH3COOH | 피부와 접촉시 심한 화상이나 수포를 발생하므로 피부와의 접촉을 피하고, 흡입시 코, 목, 기도 및 점막을 상하게 하므로 주의한다. |
5. 실험 과정




6. 실험 결과
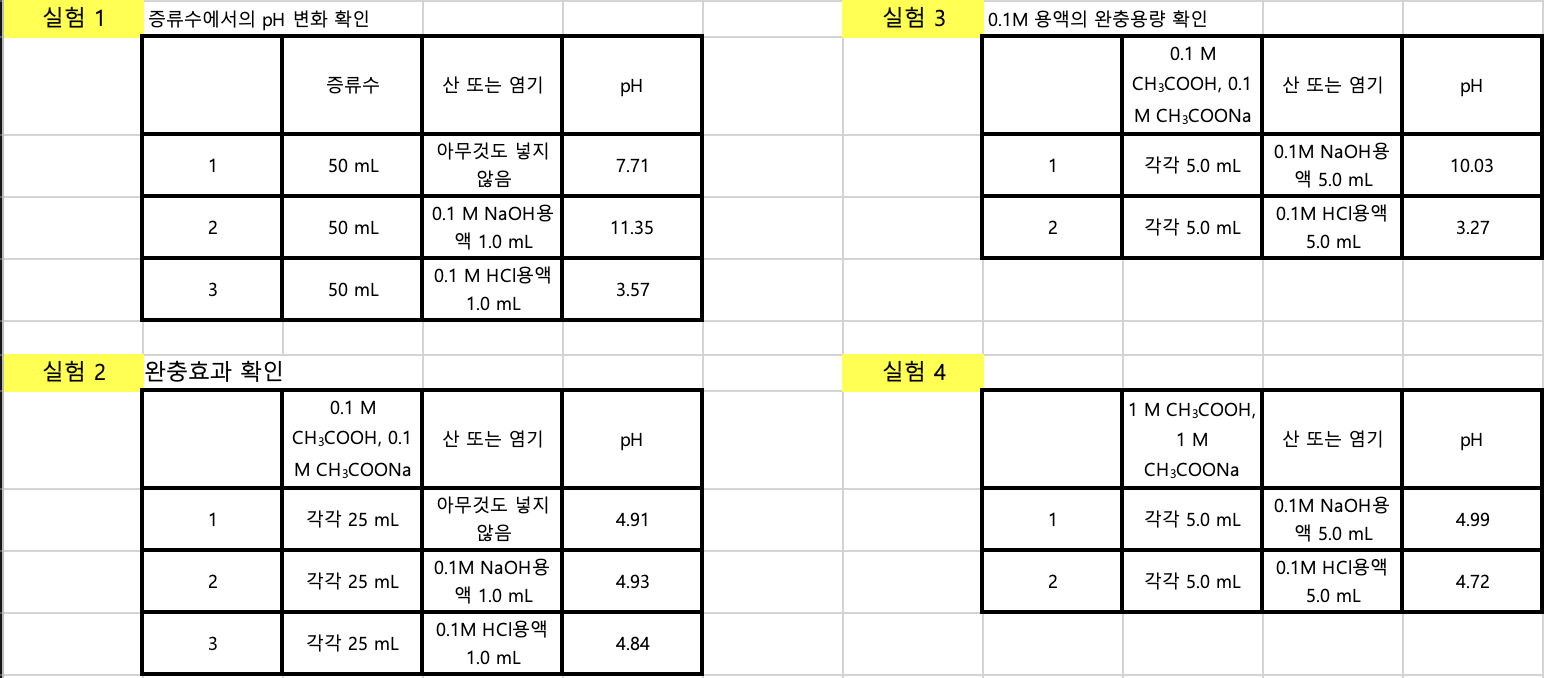
[실험 1] 증류수에서의 pH 변화 확인
[실험2] 완충효과 확인
[실험3] 0.1M 용액의 완충용량 확인
[실험4] 1M 용액의 완충용량 확인
7. 관찰과 결과분석
7-1. 0.100 mol의 CH3COOH와 0.100 mol의 CH3COONa를 섞어 1.00 L로 만든 완충용액의 pH가 1만큼 작아지려면 몇 mmol의 산을 가해 주어야 하는가? 이때 소수점 아래 첫째 자리까지 구하시오. (답안 예시 : 100.7)
A. 81.8
7-2. 위 7-1. 문항에 대한 풀이식을 작성하시오.
A.
먼저 완충용액의 pH를 Henderson-Hasselbalch 식으로 계산하면,
pH = pKa + log([짝염기]/[약산])
= 4.76 + log((0.100)/(0.100))
= 4.76
log([짝염기]/[약산]) = -1 이 되면 pH가 1만큼 감소하므로,
log([짝염기]/[약산]) = -1
[짝염기]/[약산] = 0.1
완충용액에 산을 가하면, 가한 산의 몰수만큼
약산의 몰수는 증가하고, 짝염기의 몰수는 감소하므로,
가한 산의 몰수를 x라 두면,
(0.1-x) / (0.1+x) = 0.1
0.1-x = 0.01 + 0.1x
0.09 = 1.1x
x = 0.09 / 1.1 = 0.0818
pH = 4.76 + log((0.100-0.0818)/(0.100+0.0818))
= 3.76
pH가 1만큼 감소했다.
따라서 가해 주어야 할 산의 몰수는 81.8 mmol.
7-3. pH 6인 완충용액을 100 mL 만들 때, 0.1M CH3COOH 용액은 [1] mL 0.1M CH3COONa 용액은 [2] mL씩 넣어야 한다. 이때 빈칸 [1], [2] 를 구하시오. (초산의 pK a = 4.76) 이때 소수점 아래 둘째 자리까지 구하시오.
A.
[1] = 22.44
[2] = 77.56
7-4. 위 7-3. 문항에 대한 풀이식을 작성하시오.
A.
문제에서 완충용액의 pH = 6
CH3COOH의 pKa = 4.76 라고 주어졌으므로
완충용액의 pH는 Henderson-Hasselbalch 식에 의하면
pH = pKa + log([짝염기]/[약산])
6 = 4.76 + log([CH3COO-]/[CH3COOH])
1.24 = log([CH3COO-]/[CH3COOH])
[1] = x mL, [2] = 100-x mL 이므로
[CH3COOH] = 0.1x mmol / 100mL
= 0.001x M
[CH3COO-] = 0.1(100-x) mmol / 100mL
= 0.001(100-x) M
위식에 대입하면
1.24 = log( 0.001(100-x) / 0.001x)
=log ( 100-x / x)
(100-x) = (x) x (10^1.24)
x=22.44
7-5. 일반적인 약산 HA에 대하여 Henderson-Hasselbalch 식을 유도하시오.
A.
약산의 이온화 반응식
HA(aq) ⇌ H+(aq) + A-(aq)
이때 Ka = [H+][A-]/[HA]
위 식을 [H+]에 대해 정리하면
[H+] = Ka [HA] / [A-]
양변에 -log를 취하면
-log[H+] = -log Ka - log [HA]/[A-]
-log[H+] = -log Ka + log [A-]/[HA]
pH = pKa + log [A-]/[HA]
그러므로
pH = pKa + log [짝염기]/[약산]
'일반화학실험 > 화학및 실험2(실험)' 카테고리의 다른 글
| [화학및 실험2] 8주차 결과보고서, 일감호 수질 검사 : 화학적 산소 요구량 (COD) 측정 (0) | 2025.03.16 |
|---|---|
| [화학및 실험2] 8주차 예비보고서, 일감호 수질 검사 : 화학적 산소 요구량 (COD) 측정 (0) | 2025.03.13 |
| [화학및 실험2] 7주차 결과보고서, 완충용액의 효과와 용량 확인 (0) | 2025.03.10 |
| [화학및 실험2] 6주차 결과보고서, 비타 500에 들어있는 비타민 C 정량 분석 (1) | 2024.07.14 |
| [화학및 실험2] 6주차 예비보고서, 비타 500에 들어있는 비타민 C 정량 분석 (2) | 2024.03.18 |



