1. 실험 목적 및 이론
두 가지 탄산염 (Na2CO3, NaHCO3)과 HCl의 반응에서 발생하는 CO2의 무게를 각각 측정하고, 화학양론적 계산을 통하여 일정성분비 법칙을 확인한다.
두 탄산염 Na2CO3, NaHCO3과 HCl의 반응식은 다음과 같다.

질량보존 법칙에 의해 반응물과 생성물의 질량이 정확히 같고,
두 가지 다른 반응에서 생성 된 CO2의 성분이 일정하다면, 일정성분비의 법칙에 따라 다음과 같은 결과를 예상할 수 있다.
Na2CO3에서 CO2가 빠져나갈 때 41.5 %의 무게가 줄어들 것이다.
NaHCO3에서 CO2가 빠져나갈 때 52.4 %의 무게가 줄어들 것이다.
알아야 할 개념들 (조사할 내용, 예비보고서에 있음)
- (1) 몰(mole), 몰농도(molarity, M)
- (2) 화학반응식의 균형 맞추기
- (3) 일정성분비의 법칙
- (4) 한계 반응물
2. 실험방법
(1) 저울에 weighting paper 올리고 미지시료 A, B를 각각 1.00g 씩 정확히 측정한다.
(2) 10ml 메스실린더를 이용하여 6M HCl을 5ml 취하여 50ml 비커에 옮겨 담는다.
(3) 저울 위에 (2)번 비커를 올려놓고 영점을 맞춰, 표시창의 값이 0.000이 되도록 한다.
(4) (1)과정에서 측정한 미지시료 A를 (3) 비커에 넣고, 무게 변화가 없을 때까지 5초 간격으로 무게를 측정하고, 그 값을 기록한다.
(5) 미지시료 B도 위의 (1)~(4)번 과정에 따라 수행한다.
(6) 미지시료 A, B를 같은 방법으로 반복 측정한다.
(7) 미지시료 A, B의 무게 변화로부터 각각 어떤 화합물인지 알아본다.
전자저울 사용법 (용기, weighting paper를 사용하여 무게를 측정할 경우)
- 1 저울의 균형을 맞춘다. (화학 실험실 저울은 균형을 맞춰 놓은 상태이므로 표시선 안에 항상 놓이도록 하고 움직이지 않도록 한다.)
- 2 빈 용기 (weighting paper)를 접시 위에 올려놓는다.
- 3 ON TARE (또는 영점, Re-Zero)를 눌러, 표시창의 값이 0.000이 되도록 한다.
- 4 용기에 측정할 시료를 놓고, 값을 읽는다.
- 5 저울의 측정 최대 용량(약 200g)을 넘는 시료나 기구의 측정은 고장의 원인이 될 수 있으므로 주의한다.
Safety Note
HCl은 강한 산으로 피부나 옷에 묻으면 화상의 우려가 있으니 후드에서 취할 때, 비닐장갑을 착용하고, 주의하여 다루도록 한다.
3. 기구와 시약
50ml 비커 1개, 초시계 1개, 10ml 메스실린더 1개, Na2CO3(sodium carbonate), NaHCO3 (sodium hydrogen carbonate 또는 sodium bicarbonate), 6M HCl(hydrochloric acid)
4. 실험결과





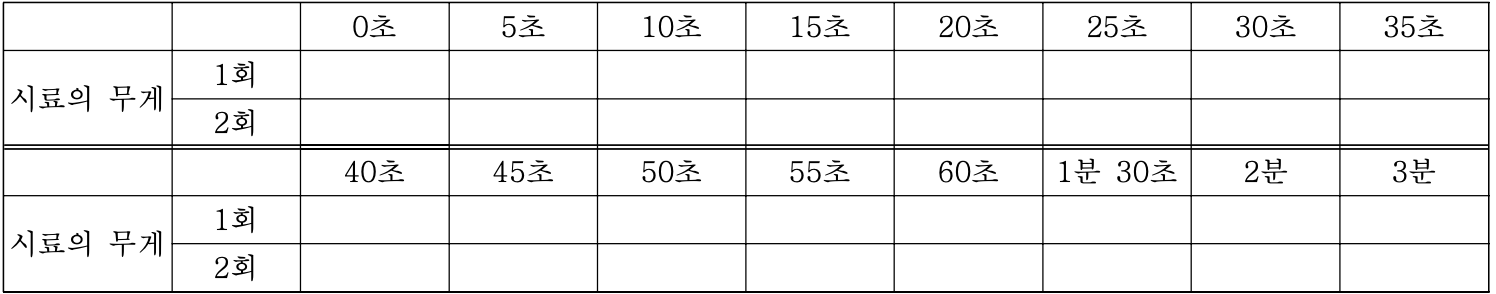
원래는 반응속도계산을 위해 표와 같이 실시간 질량 감소를 체크해야 하지만 배제 하였습니다.
1. 미지의 시료 sample A를 가지고 실험과정을 수행했을 때, 실제 실험 결과 생성된 CO2의 무게의 평균값을 구하시오. (소수점 셋째자리까지 나타내시오.)
0.514
2. 미지의 시료 sample B를 가지고 실험과정을 수행했을 때, 실제 실험 결과 생성된 CO2의 무게의 평균값을 구하시오. (소수점 셋째자리까지 나타내시오.)
0.405
5. 관찰과 결과분석
5-1. HCl과 미지시료의 반응에서 sample A는 NaHCO3이고 sample B는 Na2CO3 이다
5-2. 위 5-1 번 문항의 답안에 대한 이유를 서술하시오.
Na2CO3 + 2HCl -> 2NaCl + CO2(g) + H2O
NaHCO3 + HCl -> NaCl + CO2(g) + H2O
일정성분비의 법칙이 맞으면, (두가지 다른 반응에서 생성된 CO2의 성분이 일정하다면)
Na2CO3에서 CO2가 빠져나갈 때 41.5%의 무게가 줄어들 것이다
NaHCO3에서 CO2가 빠져나갈 때 52.4%의 무게가 줄어들 것이다.
실험결과에서 sample A는 약 51.4%가 줄어들었고 sample B는 약 40.5%가 줄어들었기 때문에 각각 예상치에 가까운 물질로 (오차가 제일 적은 경우의 수로) 추측할수 있다.
그러므로 A는 NaHCO3 B는 Na2CO3로 예상할 수 있다
5-3. 미지시료의 반응에서 한계반응물은 실험(1)에서NaHCO3, 실험(2)에서 Na2CO3 이다.
5-4. 위 5-2 번 문항의 답안에 대한 이유를 서술하시오.
우선 실험식을 먼저 적으면
Na2CO3 + 2HCl -> 2NaCl + CO2(g) + H2O 반응 비(1 : 2 : 2 : 1 : 1)
Na2CO3의 몰질량 105.99g/mol -> 1.002g ~= 0.00945372mol
HCl 5ml 몰농도 6M -> 0.005 x 6 = 0.03 mol
반응식을 써보면
Na2CO3 + 2HCl -> 2NaCl + CO2(g) + H2O
0.00945372 0.03
- 0.00945372 -0.018907 +0.018907 +0.00945372 +0.00945372
0 0.011093 0.018907 0.00945372 0.00945372
고로 한계반응물은 Na2CO3
NaHCO3 + HCl -> NaCl + CO2(g) + H2O 반응 비(1 : 1 : 1 : 1 : 1)
Na2HCO3의 몰질량 84.01g/mol -> 1.005g ~= 0.01196mol
HCl 5ml 몰농도 6M -> 0.005 x 6 = 0.03 mol
NaHCO3 + HCl -> NaCl + CO2(g) + H2O.
0.01196 0.03
-0.01196 -0.01196 +0.01196 +0.01196 +0.01196
0 0.01804 0.01196 0.01196 0.01196
고로 한계반응물은 NaHCO3이다.
5-5 이론값과 실험값의 오차를 구하고 오차의 원인을 서술하시오.
오차(%) = 이론값(%) - 실험값(%) 이라 정의하면
sample A(NaHCO3)는 52.4 - 51.4 = 1.0%의 오차
sample B(Na2CO3)는 41.5 - 40.5 = 1.0%의 오차가 발생했다.
1.실험 조건의 불일치: 실험환경에서의 온도, 압력, 농도 등의 조건이 이론값을 계산할때와 완벽히 일치 하진 않았다. 반응성이 다르게 나타나 오차가 발생했을 것이다
2.측정 방법의 오차: 실험자에 의해 반응물과 생성물의 질량, 부피, 농도 등을 측정하는과정에서 오차가 발생했을 것이다.
3. 이 실험은 화학평형을 고려하지 않았다. 비가역반응이더라도 역반응이 일어나 오차가 발생했을 것이다.
4. 반응속도: 각각 3분가량의 실험시간을 제한했다. 더 오래 했다면 반응이 더 일어나 오차를 줄였을 것이다.
'일반화학실험 > 화학및 실험1(실험)' 카테고리의 다른 글
| [화학및 실험1] 3주차 결과보고서, 스테아르산의 단층막을 이용한 아보가드로수의 결정 (0) | 2023.04.28 |
|---|---|
| [화학및 실험1] 3주차 예비보고서, 스테아르산의 단층막을 이용한 아보가드로수의 결정 (0) | 2023.04.27 |
| [화학및 실험1] 2주차 예비보고서, 탄산염들의 CO2 생성반응을 통한 일정성분비의 법칙 확인 (1) | 2023.04.27 |
| [화학및 실험1] 1주차 결과보고서, 우리나라 동전의 밀도 측정 (0) | 2023.04.27 |
| [화학및 실험1] 1주차 예비보고서, 우리나라 동전의 밀도 측정 (0) | 2023.04.04 |



