탄산염들의 CO2 생성반응을 통한 일정성분비의 법칙 확인
[실험 목적]
두 가지 탄산염(NaCO3와 NaHCO3)과 HCl의 반응에서 발생하는 CO2의 무게를 각각 측정하고, 화학양론적 계산을 통하여 일정 성분비의 법칙을 확인한다.
[실험 이론]
다음 실험 이론을 조사하시오
1. 몰(mole), 몰 농도(molarity,M)에 대해서 설명하시오
- 몰(mole, 기호: mol)은 물질량을 나타내는 국제단위계의 기본단위이며, 화학에서 많이 쓰이는 단위이기도 하다.
통상적으로 '입자'란 분자로 이루어진 물질의 경우 분자, 혹은 결정 따위의 경우 실험식의 단위 따위를 일컬으며, 때로는 원자, 전자, 광자 등의 수를 나타내기도 한다. 거시적 계의 입자수는 직접적으로 측정하기 어렵고, 또 측정하더라도 너무 크기 때문에, 편의상 물질량이라는 새로운 측정량을 도입하였다.
2019년 SI 기본단위 재정의 전에는 1몰은 탄소-12 12의 원자의 물질량을 정의되었다. 하지만 2019년에 아보가드로 상수가 N_A = 6.02214076 x 10^23 mol^-1 가 되도록 하는 단위로 재정의 되었다. 1몰에 해당하는 입자 수인 6.02214076x10^23은 아보가드로 수라고 부른다.
용액의 농도를 물질량을 이용하여 표시할 수 있는데, 몰랄농도는 단위 질량의 용매속에 들어 있는 용질의 물질량이며, 몰 농도는 단위 부피의 용액 속에 들어있는 용질의 물질량이다.
출처: 브라운 일반화학 14판 3.4장 Avogadro 수와 몰 p 102
위키백과 - 검색어: 몰(단위) - 몰농도는 주로 용액에서 정의한다. 용액의 몰농도(molarity, M) 는 용액(soln) 1L에 녹는 용질의 몰수로 정의한다.
몰 농도는 화학에서 주어진 단위 체적 내에서, 용액 속의 용질의 농도 또는 분자나 이온 그리고 원자 종의 농도의 척도가 된다.
몰농도 = 용질의 몰수/ 용액의 부피(L)
1.00몰 용액(1.00M)은 용액 1리터에 1.00mol의 용질을 포함한다. (용액 = 용매 +용질)
출처: 브라운 일반화학 14판 4.5장 용액의 농도 p157
위키백과- 검색어: '몰농도'
2. 화학반응식의 균형 맞추는 방법에 대해 간단히 설명하시오
균형 맞춘 화학 반응식을 만들기 위해서는 먼저 왼쪽에는 반응물들의 화학식을, 오른쪽에는 생성물들의 화학식을 쓴다. 그 후에 반응식의 양쪽에 각 원자수가 같아지도록 계수를 결정하여 화학 반응식을 완결한다. 일반적으로 가장 작은 정수를 계수로 사용한다.
화학 반응식을 완결하는 과정을 예로, 천연가스의 주성분인 메테인(CH_4)이 공기 중에서 연소하여 이산화탄소(CO_2) 기체와 수증기(H_2O)를 생성하는 반응을 생각해 보자
이 두 생성물은 공기중 O_2에서 오는 산소 원자를 가지고 있다. 따라서 O_2는 반응 물이고, 균형 맞지 않은 반응식은 다음과 같다.
CH_4 + O_2 -> CO_2 + H_2O (균형 맞지 않음)
C부터 시작하면 반응물 CH_4의 탄소수와 생성물 CO_2의 탄소수는 같다. 따라서 이들 물질의 계수는 같아야 하므로, 우선 계수를 모두1로 하겠다. 다음으로 H의 갯수를 맞추면
CH_4 + O_2 -> CO_2 + 2H_2O (균형 맞지 않음)
반응식은 수소와 탄소로는 균형이 맞지만 산소는 아직 균형이 맞지 않는다. O_2 앞에 계수 2를 넣으면 식의 양쪽에 O 원자수(왼쪽 2x2, 오른쪽 2 + 2 x 1)가 같게 되어 균형 맞춘 반응식으로 완결된다.
CH_4 + 2O_2 -> CO_2 + 2 H_2O ( 균형 맞음)
출처: 브라운 일반화학 14판 3.1장 화학반응식 p93~94
3. 일정성분비의 법칙에 대해서 설명하시오.
일정성분비의 법칙은 한 화합물을 구성하는 각 성분 원소들의 질량 비가 일정하다는 법칙을 말한다. 1799년 프랑스의 화학자이자 약학자인 조제프 루이 프루스트가 발견하였다. 배수 비례의 법칙과 함께 화학양론의 근간이 된다
예시)
물(H_2O)에서 수소(H)와 산소(O)의 질량 비는 항상 1:8이다. 만약 물에 수소가 차지하는 질량이 2.5g이라면, 산소 원자가 차지하는 질량은 20g이 된다.
출처: 위키백과 - 검색어: '일정 성분비 법칙'
4. 한계 반응물에 대해서 설명하시오
한 반응에서 완전히 소비되는 반응물을 한계반응물(limiting reactant)이라고 한다. 그 이유는 이 물질이 생성물의 양을 결정 또는 제한하기 때문이다.
어떤 반응이든 반응이 시작할 때는 반응물의 양에 제한이 없다. 실제로 여러 반응에서 한가지 시약을 과량으로 사용한다. 그러나 소비된 반응물의 양과 생성된 생성물의 양은 한계 반응물의 양에 의해 제한을 받는다.
예를 들면
2H_2(g) + O_2(g) -> 2H_2 O(g)
반응전 : 10mol 7mol 0mol
변화(반응): -10mol -5mol +10mol
반응 후 : 0mol. 2mol. 10mol
표의 두번째 줄은, 반응에서 소비된 반응물과 생성된 생성물의 양을 요약한 것이다. 이 양들은 한계 반응물의 양에 따라 제한되며, 균형 맞춘 반응식의 계수에도 의존한다. 반응의 끝에는 한계반응물(H_2)은 남아 있지 않다.
출처: 브라운 일반화학 14판 3.7장 한계 반응물 p115~116
5. 위 시약들의 물리적, 화학적 특성과 그 위험성에 대해 각각 서술하시오
시약
Na2CO3(Sodium carbonate)
NaHCO3(Sodium bicarbonate)
6M HCl
5-1. 탄산 나트륨(Na_2CO_3)
은 화합물의 한 종류로, 타산과 수산화 나트륨의 염이다. 유리에 주로 포함되어 있어 빛이 통과할 때 자외서능ㄹ 차단해 주는 역할을 하기도 한다. 상수도에서 정수 과정 중 pH를 조절하기 위해 사용되기도 한다. 탄산 나트륨은 나트륨 이온(Na+)이 포함되어 있어 물에 잘 녹는다.
CAS No. 497-19-8
유사명: 소다회, 타산 이나트륨염, 이나트륨 탄산, 칼신화 소다
상태, 흰색의 냄새가 나지않는 고체(분말)
물리화학적 특성
끓는점 인화점 증기압 비중
섭씨100도 자료없음 9.9E-17mmHg 2.5
위험성
건강영향: 흡입하면 유해함, 심한 눈 손상 유발
취급방법: 마개 개봉시 주의, 환기가 잘되는 곳에서만 사용, 발생되는 물질 흡입금지
저장방법: 직사광선 주의, 용기 밀폐, 환기가 잘 되는 곳에 보관
사고시 대응은 어떻게 할까요?
누출된 것을 즉시 닦고 예방조치를 준수하세요
위험하지 않다면 누출을 막으세요.
모든 점화원을 제거하세요
플라스틱 시트로 덮어 확산을 방지하세요.
환경보호를 위해 수로, 하수구, 지하실, 밀폐공간으로 유입되지 않도록 하세요.
액체를 흡수시켜 제거하고 오염지역을 세제와 물로 씻어내세요.
비산된 먼지를 제거하고 물로 가습하여 흩어지는 것을 방지하세요.
건조된 모래, 흙 등 비가연성 물질로 흡수시킨 후 화학폐기물 용기에 넣으세요
응급조치 요령
눈에 들어 갔을때: 20분 이상 흐르는 물에 눈을 씻어내세요.
피부에 접촉했을 때: 경미한 피부 접촉 시 오염부위가 확산되지 않도록 조치하세요.
흡입했을 때: 물질을 흡입했을 경우, 인공호흡을 하지 말고 적절한 호흡의료장비를 이용하세요.
먹었을 때: 물질을 먹었을 경우, 인공호흡을 하지말고 적절한 호흡의료장비를 이용하세요
출처: 위키백과- 검색어 '탄산나트륨'
MSDS 에서 '탄산나트륨' 통합검색
유해/위험성정보 근로자,관리자 정보확인
5- 2.탄산수소나트륨
은 일종의 화합물로 안정한 상태이다. 베이킹소다, 중탄산 나트륨, 중탄산 소다라고도 한다.
상온에서는 백색의 분말 상태로, 약간 쓰고 짠맛이 난다. 과량을 사용하면 피부를 부식시킨다. 의약품으로는 위산 과다에 대한 제산제로 쓰인다. 식품 및 미용제에도 쓰인다.
백색의 단사정계 결정으로 가열하면 이산화탄소와 물을 발생시키고, 탄산나트륨 무수물로 변하는 성질을 지녔다.
CAS No. 144-55-8
물질성상 : 고체, 과립의, 분말
분자량 : 84.01
응급조치요령
눈에 들어갔을때 : 물질과 접촉시 즉시 20분 이상 흐르는 물에 눈을 씻어내시오, 즉시 의료조치를 취하시오.
피부에 접촉했을 때: 물질과 접촉시 즉시 20분 이상 흐르는 물에 피부를 씻어내시오 오염된 옷과 신발을 제거하고 격리하시오 재사용 전에는 옷과 신발을 완전히 씻어내시오 즉시 의료조치를 취하시오
흡입했을 때: 긴급 의료조치를 받으시오, 신선한 공기가 있는 곳으로 옮기시오 호흡하지않는 경우 인공호흡을 실시하시오 호흡이 힘들 경우 산소를 공급하시오
먹었을 때: 의식이 없는 사람에게 입으로 아무것도 먹이지 마시오
출처 : 위키백과 - 검색어 '탄산수소 나트륨'
MDSD 에서 통합검색 '이탄산 나트륨'
5- 3. 염산(HCl)
은 염화 수소 수용액이다. 염화수소산, 염강수 라고도 하며, 대표적인 강산이다. 강산이기 때문에 물을 넣어 많이 희석한 '묽은 염산'이 많이 이용된다. 위산의 주 성분이며 산업에 널리 이용되기도 한다. 부식성이 있기 때문에 주의해서 다룰 필요가 있다.
CAS No. 7647-01-0
유사명 염산(무수물)
상태 무색의 자극적인 냄새가 나는 압축 액화 가스
물리화학적 특성
끓는점 인화점 증기압 비중
섭씨-85도 자료없음 88mmHg. 1.00045
주의사항이 무엇일까요?
심한 피부화상 및 눈 손상 유발
심한 눈 손상 유발
흡입시 알레르기 반응, 천식 또는 호흡곤란 유발
치아 부식증 유발
사고 시 대응은 어떻게 할까요?
누출된 것을 즉시 닦고 예방조치를 준수하세요.
위험하지 않다면 누출을 막으세요.
오염지역을 환기하고 격리하세요.
물을 분무하여 증기를 줄의되 누출물이나 용기에 물이 들어가지 않도록 하세요.
환경보호를 위해 수로, 하수구, 지하실, 밀폐공간으로 유입되지 않도록 하세요.
액체를 흡수시켜 제거하고 오염지역을 세제와 물로 씻어내세요.
누출물을 수거하세요.
건조된 모래, 흑 등 비가연성 물질로 흡수시킨 후 화학 폐기물 용기에 넣으세요.
응급조치 요령
눈에 들어 갔을때: 물로 조심해서 씻고 콘택트렌즈를 제거하세요.
피부에 접촉했을 때: 화상이 발생한 경우, 찬물로 식힌 후 피부에 들러붙은 옷을 제거하지마세요.
흡입했을때: 호흡이 힘들 경우, 신선한 공기가 있는 곳으로 옮기세요
먹었을 때 : 물질을 먹었을 경우, 인공호흡을 하지말고 적절한 호홉의료 장비를 이용하세요.
출처 : 위키백과 - 검색어 '염산'
MSDS 유해/위험성정보에서 '염화수소' 관리자 정보 확인
6. 빈칸 채우기~(노랑색)
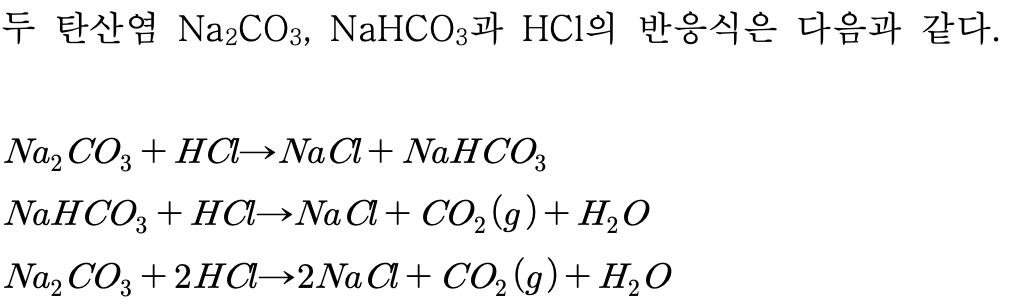
일정성분비의 법칙이 맞으면,
(두 가지 다른 반응에서 생성된 CO2의 성분이 일정하다면,)
Na2CO3에서 CO2가 빠져나갈 때 41.5 %의 무게가 줄어들 것이다.
NaHCO3에서 CO2가 빠져나갈 때 52.4 %의 무게가 줄어들 것이다.
출처
https://ko.wikipedia.org/wiki/%EB%AA%B0_%EB%86%8D%EB%8F%84
몰 농도 - 위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. 몰 농도(molarity 또는 Molar concentration)는 용액 1리터 속에 녹아 있는 용질의 양을 몰로 나타낸 것을 말한다.[1] 몰 농도는 화학에서 주어진 단위 체적 내에서, 용액
ko.wikipedia.org
https://ko.wikipedia.org/wiki/%EC%9D%BC%EC%A0%95_%EC%84%B1%EB%B6%84%EB%B9%84_%EB%B2%95%EC%B9%99
일정 성분비 법칙 - 위키백과, 우리 모두의 백과사전
위키백과, 우리 모두의 백과사전. 일정 성분비 법칙(一定 成分比法則) 또는 정비례의 법칙(定比例法則)은 한 화합물을 구성하는 각 성분 원소들의 질량 비가 일정하다는 법칙을 말한다. 1799년 프
ko.wikipedia.org
https://msds.kosha.or.kr/MSDSInfo/kcic/msdssearchMsds.do
안전보건공단 화학물질정보 | MSDS검색
본문내용 산업안전보건법 제110조 및 111조에 의거 유통되는 화학물질 및 화학물질을 함유한 제제의 물질안전보건자료(MSDS)는 해당 물질을 양도하거나 제공(제조·수입·판매자(도·소매업자))하
msds.kosha.or.kr
'일반화학실험 > 화학및 실험1(실험)' 카테고리의 다른 글
| [화학및 실험1] 3주차 결과보고서, 스테아르산의 단층막을 이용한 아보가드로수의 결정 (0) | 2023.04.28 |
|---|---|
| [화학및 실험1] 3주차 예비보고서, 스테아르산의 단층막을 이용한 아보가드로수의 결정 (0) | 2023.04.27 |
| [화학및 실험1] 2주차 결과보고서, 탄산염들의 CO2 생성반응을 통한 일정성분비의 법칙 확인 (0) | 2023.04.27 |
| [화학및 실험1] 1주차 결과보고서, 우리나라 동전의 밀도 측정 (0) | 2023.04.27 |
| [화학및 실험1] 1주차 예비보고서, 우리나라 동전의 밀도 측정 (0) | 2023.04.04 |



